Лечение псевдомембранозного колита ванкомицином – Псевдомембранозный колит
Псевдомембранозный колит
Патогенез псевдомембраного колитаДоказано, что Clostridium difficile может обнаруживаться в стуле здоровых людей. Одновременноо, имеются убедительные данные, указывающие на то, что эти микроорганизмы не способны к длительному существованию в неизмененной нормальной микроэкосистеме кишечника.
Для осуществления патогенных свойств этого микроорганизма необходимы условия, способствующие его избыточному росту, которые возникают в результате применения антибиотиков, то есть проведения антибиотикотерапии.
К основным антибактериальным препаратам, связанным с развитием псевдомембранозного колита, относят цефалоспорины (особенно 2 и 3 поколений), ампициллин, амоксциллин и клиндамицин. Менее причинно-значимыми антибиотиками являются макролиды (эритромицин, кларитромицин, азитромицин) и другие пенициллины. Однако следует учитывать, что практически любой антибактериальный препарат может привести к возникновению псевдомембранозного колита.
Длительное применение антибиотиков или же одновременное применение 2-х и более антибактериальных препаратов ещё более повышает риск развития псевдомембраного колита.
Заболевание развивается при развитии резистентности Clostridium difficile к антибиотикам, подавляющим жизнедеятельность прочей кишечной микрофлоры. Таким образом, возникновение псевдомембранозного колита является результатом развития своеобразного “клостридиального” дисбактериоза у больных под влиянием различных предрасполагающих факторов.
Патогенные штаммы C. difficile продуцируют токсин А и токсин В. Токсин А – мощный энтеротоксин с цитотоксической активностью, вызывающий нарушение барьерной функции слизистой кишечника за счет повреждения эпителиоцитов и активацию секреции жидкости в просвет кишечника. Токсин B – цитотоксин, в 1000 раз более мощный цитотоксин, чем токсин А, его цитотоксический эффект обусловлен нарушением полимеризации внутриклеточных филаментов актина).
Токсины C.difficile воздействует на слизистую оболочку кишечника, вызывая в ней глубокие изменения, вплоть до перфорации. Некоторые антибиотики, особенно линкомицин, клиндамицин, ампициллин индуцируют продукцию цитотоксина, повышая его уровень в 16-128 раз без прироста биомассы микроорганизма; несколько меньше, но также повышается продукция энтеротоксина.У C.difficile описаны плазмиды, которые участвуют в переносе устойчивости к антибиотикам.
Выявляемые в толстой кишке морфологические изменения слизистой обусловлены действием только токсинов, поскольку сами клостридии не обладают инвазивными свойствами и, как правило, в подслизистый слой не проникают. Протяженность и глубина морфологических изменений, выявляемых в толстой кишке, обусловливают тяжесть течения инфекционного процесса.
www.smed.ru
Псевдомембранозный колит – Лечение | Компетентно о здоровье на iLive
Лечение псевдомембранозного колита в лёгком и средне-тяжелом течении
Обычно назначают метронидазол в дозе 250 мг 4 раза в сутки в течение 10-14 сут. Стоимость ванкомицина для приема внутрь существенно выше, кроме того, эта форму никогда не ввозили в РФ. Поэтому рекомендован прием внутрь раствора препарата, предназначенного для внутривенного введения в той же дозировке, как и внутрь. Широкое использование препарата внутрь может привести к возрастанию резистентности энтерококков к ванкомицину. Именно поэтому при нетяжелом течении предпочтение отдают метронидазолу.
Лечение псевдомембранозного колита в тяжёлом течении
В случае очень тяжелого или жизнеугрожающего течения инфекции многие специалисты рекомендуют применять ванкомицин в дозе 125 мг 4 раза в сутки в течение 10-14 сут. Существует общее мнение о необходимости сокращения потребления ванкомицина из-за высокой вероятности нарастания резистентности энтерококков.
Бацитрацин
Применяют в дозе 25 000 ед или 500 мг 4 раза в сутки в течение 10-14 сут вместо метронидазола и ванкомицина. Клиническая эффективность существенно ниже. Кроме того, в форме для приема внутрь препарата в РФ нет.
При невозможности приема препарата внутрь оптимальный режим терапии неизвестен. Предварительные данные указывают на преимущества внутривенного введения метронидазола (500 мг через 6 ч) по сравнению с ванкомицином, что актуально у пациентов с кишечной непроходимостью. Дополнительно назначают внутрь ванкомицин через зонд, илеостому, колостому или в клизме в более высокой, чем обычно, дозе (500 мг через 6 ч). Обычно рекомендуют определять уровень ванкомицина в плазме крови, чтобы избежать его передозировки.
Колестирамин
Применяют при средне-тяжелом течении заболевания Он способен связывать токсин В и, возможно, токсин А, снижая таким образом их биологическую активность. Из-за его способности связывать ванкомицин не реко-мендовано их совместное применение.
[19], [20], [21], [22], [23], [24], [25], [26], [27], [28], [29]
Лактобактерии ацидофильные
Роль лактобацилл в качестве заместительной терапии неясна, поэтому их не рекомендуют.
Опиаты и препараты с антиперистальтигеским действием
Препараты этих групп противопоказаны, особую опасность представляют у детей, так как могут способствовать утяжелению состояния. Это связано с секвестрацией жидкости в просвете кишечника, усилением всасывания токсинов в толстой кишке. При этом отмечают более значительные поражения толстой кишки.
Лечение псевдомембранозного колита у детей
Если это возможно, то антибактериальная терапия, послужившая причиной заболевания, должна быть прекращена.
Ванкомицин
У детей с тяжёлым токсикозом или диареей основной препарат – ванкомицин в дозе 10 мг/кг через 6 ч внутрь в течение 10 сут.
Метронидазол
Назначают внутрь или внутривенно 10 мг/кг через 6 ч внутрь или внутривенно. Режим обладает сходной эффективностью с ванкомицином, но существенно дешевле. Безопасность этого режима у детей не установлена, поэтому в некоторых странах его не применяют.
Колестирамин
Не исследован по этому показанию у детей, поэтому не рекомендуется.
Лечение рецидива инфекции, возникшего после курса антибактериальной терапии. У 10-20% пациентов диарея возникает вновь после проведения лечения ванкомицином или метронидазолом. В некоторых случаях это может быть не рецидив инфекции, а новое инфицирование другим штаммом С. difficile, что было обнаружено у пациентов с психическими нарушениями. В этих случаях оптимальная тактика лечения не определена. Обычно применяют 7-14-суточные курсы метронидазола или ванкомицина внутрь. Более продолжительное применение антибиотиков не приводит к эрадикации С. difficile и не предотвращает рецидива заболевания. Короткие курсы антибактериальной терапии позволяют более быстро восстановить нормальную флору кишечника, которая обычно подавляет рост С. difficile.
Около 3% клинически значимых штаммов С. difficile могут быть резистентными к метронидазолу, резистентность к ванкомицину не обнаружена. Для лечения лёгких и среднетяжёлых форм заболевания обычно назначают повторный курс метронидазола. При тяжелом течении предпочтительно назначение ванкомицина внутрь. Тактика лечения пациентов с жизнеугрожающим рефрактерным течением инфекции не определена.
Роль колонизации толстой кишки с помощью приема внутрь живых лактобацилл не установлена. Есть отдельные сообщения о попытке лечения взрослых пациентов с помощью капсул (1-2 капсулы 3 раза в сутки), содержащих около 500 000 лактобацилл в каждой.
Другой непатогенный биотерапевтический препарат – живые Saccharomyces boulardii, которые используют с 50-х годов для лечения диареи в Европе. Более поздние данные из США указывают на их эффективность в лечении диареи, однако необходим больший клинический опыт, особенно в отношении диареи, вызванной С. difficile.
ilive.com.ua
Псевдомембранозный колит – Лечение поноса
Псевдомембранозный колит – воспаление толстой кишки после антибиотиков
Псевдомембранозным колитом называется заболевание толстого кишечника, носящее воспалительный характер. В некоторых случаях причиной воспаления бывают антибиотики. В основной массе случаев болезнь связана с распространением в кишечнике болезнетворных бактерий, но его могут вызывать и иные микроорганизмы.
Псевдомембранозный колит может стать причиной опасных, болезненных симптомов, кроме того привести к летальному исходу. Однако это заболевание можно эффективно лечить.
Симптомы псевдомембранозного колита
Симптоматика заболевания чаще всего проявляется спустя трое суток после приёма курса антибиотиков, однако они могут проявляться и спустя несколько десятков дней после прекращения этого лечения. Во всяком случае, на течение процесса оказывают влияние множество факторов. К симптомам псевдомембранозного колита можно отнести следующие состояния:
К врачу следует обращаться в случае развития указанных симптомов, если приём антибиотиков был проведен недавно. Вероятнее всего речь идёт о колите псевдомембранозного типа. В этом случае необходимо проведение комплексного лечения, поэтому к врачу надо обращаться до того, как станет хуже.
Причины псевдомембранозного колита
Главной причиной возникновения описываемой разновидности колита является приём антибиотиков. В принципе абсолютно любой антибиотик способен подавить кишечную микрофлору и стать причиной начала болезни.
Чаще всего описываемое заболевание развивается из-за следующих медикаментозных средств:
- фторхинолонов, таких, как офлоксацин, левофлоксацин, ципрофлоксацин;
- пенициллинов, к ним можно отнести амоксициллин и ампициллин;
- цефалоспоринов, таких, как цефтриаксон, цефиксим, цефотаксим;
- клиндамиксин.
Кроме того, причиной развития болезни может стать приём токсичных лекарственных средств, например, применяемых при лечении рака в целях проведения химиотерапии. Временами происходит разрушение стенок и микрофлоры кишечника при приёме этих средств и возникают те же неприятности.
Также возможно проявления заболевания у людей с симптомами воспаления кишечника, к которым можно отнести нетипичную форму язвенного колита.
Псевдомембранозный колит лечение
Для того, чтобы лечить эту болезнь, следует, прежде всего, прекратить приём антибиотиков и препаратов, назначенных для борьбы с болезнетворными бактериями. При крайне редких обстоятельствах потребуется оперативное вмешательство. Прежде чем прекращать приём антибиотиков, требуется получить разрешение на это со стороны лечащего врача, который прописал препараты. Если человек серьёзно заболел и нуждается в приёме лекарственных средств, только врач в состоянии определить, насколько ему необходимо их принимать. В некоторых случаях для остановки развития псевдомембранозной формы колита требуется прекращение приёма антибиотиков, во всяком случае, состояние больного может существенно облегчиться.
Если же у больного налицо все признаки заболевания, врачом могут быть назначены для приёма иные антибиотические средства, в целях угнетения болезнетворных микроорганизмов или иных возбудителей колита. Возможно со стороны это выглядит нелогично, когда врачом прописываются антибиотики для лечения заболевания, которое они же и вызвали, но это в порядке вещей. К тому же, для восстановления полноценного функционирования кишечной микрофлоры могут быть показаны к приёму такие препараты, как Бифиформ или Линекс.
После начала проведения лечебной процедуры, состояние пациента должно облегчиться спустя короткое время, однако для того чтобы нормальное функционирование кишечника полностью восстановилось, необходимо несколько недель.
Даже если лечение заболевания было проведено полностью и качественно, возможны её рецидивы спустя некоторое время, это могут быть месяцы или недели. В таких случаях возможно назначение хирургического вмешательства, как средства избавления от проблемы.
В редких случаях лечащий врач может настоять на оперативном вмешательстве. В том случае, если у больного отмечается прогрессирующая форма недостаточности внутренних органов, оперативное вмешательство может привести к разрыву кишечника и перитониту. При этом хирургом будут удалены части воспалившегося кишечника и устранены добавляющиеся проблемы.
Лечение псевдомембранозного колита ванкомицином
Псевдомембранозный колит является достаточно редким, но при этом, опасным заболеванием, которое вызывает микроб Clostridium difficile. Эта разновидность микроорганизмов проявляет повышенную чувствительность к различным антибиотикам. Что касается ванкомицина, то его стандартная дозировка для лечения заболевания измеряется в объёме 500мг, однако согласно данным исследований, дозировка в 125 мг четырежды в сутки вполне достаточна для того, чтобы купировать воспалительный процесс. Лечение вышеописанного заболевания ванкомицином рекомендуется проводить при особенно тяжёлых формах течения заболевания. Рекомендованный курс лечения продолжается десять дней. Особо тяжёлые стадии описываемой болезни предполагают смешанное применение ванкомицина и метронидазола, при этом вводится средство внутривенно. Не следует, однако забывать о том, что внутривенное введение препаратов не столь эффективно.
Лечение псевдомембранозного колита метронидазолом
При лечении псевдомембранозного колита Метронидазол следует назначать к приёму вовнутрь либо же вводить внутривенно по 10 миллиграммов в расчёте на килограмм живого веса пациента с перерывом в шесть часов. Препарат значительно дешевле, чем ванкомицин, при этом порядок приёма антибиотиков весьма схож и, как было описано выше, допускается совместное их применение. До сих пор не известна степень воздействия препарата да растущий детский организм, поэтому применять его для лечения детей не рекомендуется. Существет определённая категория стран, в которых препарат вообще запрещён к применению, когда речь заходит о необходимости лечения детей.
Диета
Режим питания при заболевании данного рода предполагает употребление в пищу белка в повышенном содержании и сниженную концентрацию объёма потребляемых жиров. Лечение псевдомембранозной разновидности колита предполагает отказ от приёма в пищу таких блюд, как колбасы всевозможных сортов, продукты на солевой основе и копчёности всех видов, пшёнка и другие виды круп, все соки фруктовых деревьев. Диета допускает только употребление варёных овощей. Необходимо запекание слив и груш. Супы следует есть только лишь в виде пюре и кремов, при этом хлеб надо есть лишь вчерашний или просушенный, при этом размачивая его. Не следует употреблять в пищу холодные десерты или блюда с пылу с жару. Соки из фруктов надо разбавлять водой, при этом груши и яблоки очищать от семян и шкурки. Нельзя есть копчёного, жареного, жирного.
Диагностика
Для того чтобы правильно провести диагностику определённой разновидности колита колита необходимо выполнение ряда обязательных мероприятий:
- проведение анализа кала. Должны быть проведены лабораторные исследования на предмет обнаружения возбудителей заболевания, а также прочих микробов;
- проведение анализа крови. Этот анализ необходим для определения уровня содержания лейкоцитов в крови. Псевдомембранозный колит предполагает повышенную концентрацию их в крови;
- проведение осмотра толстого кишечника. Оно подразумевает проведение колоноскопии, предполагающей введение в область кишечника пациента трубки, которая содержит на своём окончании миниатюрную камеру. Для развития псевдомембранозной разновидности колита характерно обнаружение признаков воспаления кишечной полости;
- проведение рентгена и компьютерной томографии. Проявление серьёзных симптомов заболевания требует назначения врачом проведения стандартного рентгена или информативной компьютерной томографии, для обнаружения разрыва кишечных стенок или мегаколона.
Осложнения
Псевдомембранозный колит опасен тем, что к моменту постановки диагноза, если ранее не применялись никакие меры лечения заболевания, уже можно застать человека тяжело больным.
В том случае, если никаких мер к лечению заболевания не предпринимается, возможно начало серьёзных осложнений развития заболевания. К числу таковых можно отнести:
- гипокалемию, болезнь, характеризующуюся ненормально низким уровнем содержания калия в крови пациента. Такое бывает возможным после избыточного устранения калия из организма в результате поноса;
- обезвоживание организма, происходящее по причине потери большого объёма жидкости. Это может способствовать снижению давления и другим неприятностям;
- болезни почек. Наиболее опасное проявление снижения уровня давления и недостаточности почек;
- кишечная перфорация, отмечающаяся перитонитом, инфекционным поражением полости брюшины;
- проявление токсического мегаколона. Заболевание кишечника достаточно редкое и опасное, может закончиться прекращением способности кишечника проталкивать газы и массы кала. Может произойти разрыв стенок кишечника.
В основной массе случаев своевременно проведенное лечение устраняет заболевание и благотворно влияет на здоровье пациента. Если же человека не лечить, ситуация может закончиться плачевно для него. Именно этим объясняется необходимость обращения к врачу при первых симптомах заболевания, не тратя времени на самолечение.
Похожие статьи:
Частая дефекация
Хологенная диарея
Синдром раздраженной кишки
Поносы при колитах
Кишечная гиперсекреция
- < Назад
- Вперёд >
ponos-x.com
Война с «трудной» бактерией: что известно о псевдомембранозном колите |
Это тяжелое воспаление толстой кишки, при котором на слизистой кишечника появляются желтоватые, сливающиеся между собой бляшки. Болезнь проявляется болью в животе, поносом, кровью в стуле. Осложнения заболевания очень серьезны и могут закончиться летальным исходом.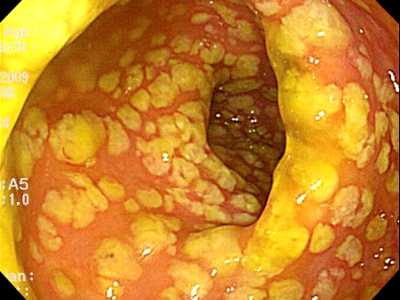
Самая частая (не исключено, что и единственная) причина псевдомембранозного колита — активное размножение в толстом кишечнике Clostridium difficile, в норме находящейся в кишечной микрофлоре в очень малых количествах.
Врачу необходимо учитывать менее распространенные причины болезни, поскольку к такой клинике могут привести другие заболевания: болезнь Бехчета, коллагеновый колит, болезнь Крона и неспецифический язвенный колит, другие микроорганизмы (бактерии, паразиты, вирусы). К тому же болезнь могут вызвать ряд наркотических средств и токсинов. Правильно определенная причина заболевания позволит корректировать лечение и прогнозировать ход болезни.
Хирургия псевдомембранозного колита имеет дело с перфорацией толстой кишки, гангренозным поражением стенки кишечника и при очень тяжелом течении заболевания (в тяжелых случаях проводят колэктомию с формированием энтеростомы).
До применения антибиотиков широкого спектра действия колит чаще ассоциировался с ишемией кишечника, кишечной непроходимостью, отравлением тяжелыми металлами. Сейчас есть несколько причин, приводящих к заболеванию, но в подавляющем большинстве случаев — это C. Difficile.
В иностранной литературе такие нозологические формы получили название нозокомиальных колитов, или колитов, ассоциированных с С. Difficile (CDAD, или Clostridium difficile antibiotic associated diarrhea)
«Трудная» клостридия
Бактерия Clostridium difficile впервые была описана Холлом и О’ Толе (Hall and O’Toole) в 1935 году. Неизвестный на тот момент микроорганизм получили из кала грудного ребенка и назвали «difficile»(по-латыни — трудный, несговорчивый) из-за большой сложности его культивирования. Несколько позже бактерия была отнесена к клостридиям. После открытия пенициллина и начала активного применения антибиотиков врачи описывали «кровавую диарею», но как причину псевдомембранозного колита «трудную» клостридию стали воспринимать только после работ Джона Бартлетта в 1978 году.
Clostridium difficile является грамположительной крупной палочкой, которая способна формировать споры. Споры бактерии очень устойчивы во внешней среде и способствуют ее распространению. Встречается микроорганизм в окружающей среде, а также кишечнике человека и животных.
Близкие родственники этой бактерии:
— C. botulinum, возбудитель ботулизма
— C.perfringens , возбудитель газовой гангрены
— C.tetani, возбудитель «болезни босых стоп», или столбняка.
Причем первая и третья клостридии занимают такие же места в соревновании по выработке самый сильный из известных ядов. На втором месте — дифтерийная палочка со своим дифтерийным токсином.
Clostridium difficile тоже своей известности обязана вырабатываемым ею токсинам.
Эта бактерия является обитателям нормальной кишечной микробиоты толстой кишки. Важно то, что количество этих бактерий и их активность очень низкая. В норме в кишечнике человека обитает 0,01-0,001% C. difficile от общего числа бактерий (и достигать при болезни 15-30%).
Довольно редко выявляются в фекалиях здоровых людей — около 3%. У госпитальных больных частота возрастает до 30%.
Очень интересно то, что у здоровых детей бактерия выделяется в почти половине случаев, а у детей грудного возраста — до 90%. Считают, что токсин C.difficile на кишечный эпителий новорожденных просто не действует (псевдомембранозный колит у младенцев не развивается).
Патогенез
Первым шагом в механизме развития заболевания является нарушение нормальной микрофлоры толстой кишки с последующей ее колонизацией C. difficile. Обычно этот процесс является следствием приема антибиотиков, но может быть после химиотерапии и приема цитостатиков, у пациентов с иммунодефицитом.
В норме у клостридии очень много «конкурентов». Еще важно то, что спорам ее практически не позволяют развиваться в активную вегетативную форму. Антибиотик уничтожает окружающую «несговорчивую» бактерию микрофлору и она начинает размножаться. Более того: «просыпаются» споры бактерии, которым в кишечнике в норме просто не дают расти. Находящаяся в вегетативной форме клостридия начинает вырабатывет экзотоксины. Большая часть патогенных штаммов продуцирует два таких: токсин А (энтеротоксин) и токсин B (цитотоксин, считают в патогенезе основным). Точка приложения их — рецепторы слизистой оболочки толстой кишки. Повреждается как структура клетки, так и межклеточные контакты. Эпителиальные клетки отслаиваются: формируются микробреши в кишечном барьере. На защиту поврежденного фрагмента кишки привлекается большое количество «больших пожирателей» — макрофагов.
Псевдомембраны формируются из-за притока большого количества макрофагов на место поврежденной слизистой оболочки. Псевдомембраны — морфологический признак псевдомембранозного колита — это пленки фибрина, образовавшиеся на участках некроза клеток эпителия слизистой кишки, макроскопически выглядящие как бледные серовато-желтые бляшки размером достигающие 2 сантиметров.
За счет повреждений слизистой в подслизистый слой массово проникают иммунные клетки. Возникает отек и кровоизлияния. При очень тяжелых случаях бляшки сливаются в сплошную зону поражения
Псевдомембранозный колит: симптомы и клиника
Клиника болезни и те жалобы, которые предъявляет пациент очень вариабельны. Болезнь может развиться как в процессе лечения антибиотиками, так и через некоторое время. Обычно симптомы появляются в течение первой недели после курса антибиотиков, но описаны случаи отсроченного развития болезни (через 1,5-2 месяца).
На что будет жаловаться пациент? Жидкий стул, боль в животе и повышение температуры.
Основной и ключевой симптом псевдомембранозного колита — диарея. Понос наблюдается практически всегда. Но не стоит паниковать если у Вас было «расстройство» в течение двух-трех дней после антибиотикотерапии. Легкий дисбиоз обычно проходит самостоятельно. А вот при клостридиальном колите стул очень часто — до 10-20 раз в сутки, водянистый. Могут быть прожилки крови. Диарея носит упорный характер и может сохраняться до 2 месяцев. И боли в животе. Поврежденная слизистая провоцирует боли спастического характера. Боли в животе чаще не имеют четкой локализации (обычно по ходу толстого кишечника).
Реже, в более тяжелых случаях, в клинике заболевания присутствует лихорадка. Чаще всего цифры небольшие. Высокие цифры характерны для тяжелых форм болезни.
Сложнее в плане диагностики бывает тогда, когда заболевание проявляется высокой температурой и болями в животе. Причем вначале болезни может быть парез кишечника и поноса может не быть. Клиника может напоминать «синдром острого живота». Поэтому всегда сообщайте врачу о приеме накануне антибактериальных препаратов.
Осложнения псевдомембранозного колита
1. Гипокалиемия. Снижение количества калия в крови. Причина в диарее и потере жидкости.
2. Эксикоз (обезвоживание). Причина та же.
3. Токсический мегаколон. Или токсическая дилатация толстой кишки.
Про этот синдром стоит написать отдельную статью. Считается, что токсическая дилатация вызвана снижением тонуса гладкой мускулатуры толстой кишки по причине повышения концентрации NO (оксида азота) в гладкомышечных волокнах. Боль в животе, кровь с примесью гноя в стуле. Общая слабость, снижение артериального давления. Токсический мегаколон четко выявляется при рентгенографии брюшной полости (увеличение диаметра толстой кишки более 6 см)
При этом осложнении высок риск еще одного:
4. Перфорация толстой кишки.
Боли в животе значительно усиливаются. Возникает рефлекторное повышение тонуса брюшного пресса. Больной боится пошевелиться. Развивается перитонит. Это неотложное хирургическое состояние.
Как будем выявлять клостридию?
Общий анализ крови
В общем анализе крови при псевдомембранозном колите есть характерные изменения показателей. Если диарея связана с C. Difficile, отмечается выраженный лейкоцитоз (выше 15*10^9). Этот анализ прост и полезен при первоначальном подозрении на клостридиальный колит.
Культуральное исследование
Начиная с 70-х годов 20-го века этот метод был широко распространен. Микроорганизм выращивают на специальных средах. Сейчас применяется значительно реже, так как это требует значительное время (пациент нуждается в немедленном лечении). К тому же (и хотя метод очень чувствителен), выделив культуру нельзя сказать, вырабатывает она токсин или нет. На питательной среде одинаково растут как токсигенные, так и нетоксигенные штаммы. Выделив культуру, остается только идентифицировать производство токсинов. Эффективность в таком случае не будет уступать анализу нейтрализации цитотоксина (CCCN)
ИФА (Иммуноферментный анализ)
Метод иммуно-ферментного анализа, применяемый для выявления токсинов А и В в течение многих лет был наиболее значимым диагностическим тестом. Однако сейчас ввиду плохой чувствительности анализа как отдельный тест не проводится. К тому же для диагностики псевдомембранозного колита необходимо определять именно два токсина. Есть штаммы, имеющие какой-то один токсин.
Теперь о специфических анализах
Анализ нейтрализации цитотоксина клеток (Cell culture cytotoxin neutralization, или CCCN)
Этот метод основан на определении цитотоксина В в каловом материале. В течение многих лет считался «золотым стандартом». В последнее время исследователи отмечают недостаточную чувствительность (токсин в каловом материале довольно быстро разрушается).
Фильтрат образца стула помещают в среду с чувствительными клеточными культурами. Обычно для этого используют фибробласты человека. Если токсин присутствует в материале — клетки закругляются. Для более точной диагностики материал вводят к клеткам вместе с антителами с цитотоксину. В таком случае цитотоксический эффект не наблюдается.
Метод считается одним из лучших, но трудоемкий и дорогой. К тому же, как и культуральное исследование (конечно по срокам поменьше), тоже требует времени, около 48 часов.
Исследование на наличие глутаматдегидрогеназы (GDH, glutamate dehydrogenase)
GDH представляет собой фермент, который продуцируется C. Difficile (иногда, правда, и другими клостридиями). В каловом материале он относительно стабилен. Только продуцируется он как токсигенными так и нетоксигенными штаммами. Поэтому для диагностики псевдомембранозного колита его применять изолированно нельзя. Метод очень чувствителен и поэтому полезен как скрининг (но только в составе многоэтапной диагностики).
Метод амплификации нуклеиновых кислот (МАНК). Или тест NAAT(Nucleic acid amplification test)
Это разновидность метода ПЦР. Суть метода — многократное копирование короткого (уникального для каждой бактерии фрагмента ДНК). При псевдомембранозном колите выявляют наличие гена токсина В (tcdB). По рекомендациям American Society for Microbiology — это самый лучший метод. Результаты NAAT можно получить быстро, он очень чувствителен. Но обнаруживает он только ген токсина, а не наличие самого токсина. Тем более есть пациенты-носители. То есть есть риск ложного положительного результата. К тому же метод сейчас очень дорогой.
Эндоскопия
Колоноскопия обычно не рекомендуется, если имеются типичные симптомы и псевдомембранозный колит подтвержден лабораторными анализами. Это связано с потенциальным риском исследования (перфорация). Тем не менее, эндоскопическое исследование может быть полезно у пациентов с нетипичной клиникой и отрицательным лабораторным результатом.
При колоноскопии в толстой кишке выявляют беловато-желтые бляшки, которые образуют псевдомембраны на поверхности слизистой оболочки. Псевдомембраны могут иметь диаметр до 2 сантиметров, разбросанных по районам с нормальной и гиперемированной слизистой оболочки. Однако, псевдомембраны, сплошь покрывающие слизистую, можно увидеть при тяжелых формах болезни.
При легких формах заболевания могут наблюдаться признаки неспецифического колита: покраснение, отек и «рыхлость» слизистой оболочки. Псевдомембраны могут отсутствовать или слишком малы для визуализации.
Рентгенография
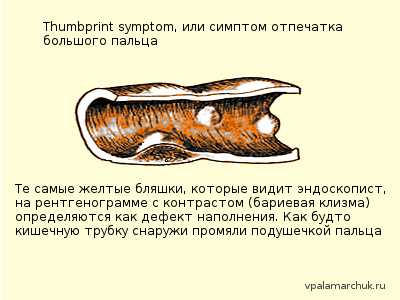
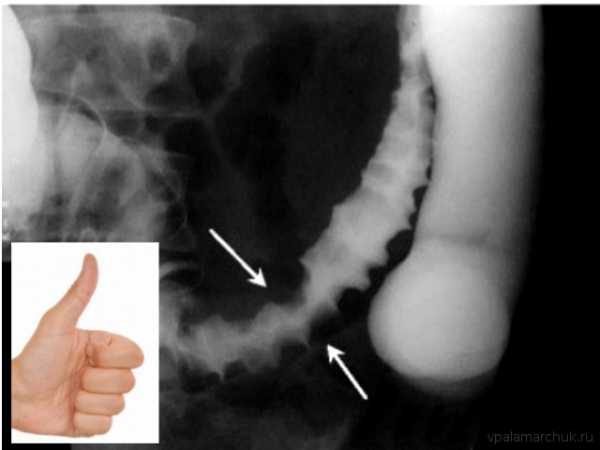
Метод неинвазивен и может быть очень полезен. Обзорная рентгенография брюшной полости может выявить клинику кишечной непроходимости. При рентгенографии с использованием контраста при псевдомембранозном колите может наблюдаться утолщенная стенка кишки (в норме стенка не видна), а также симптом «большого пальца»: дефект контрастирования в результате кровоизлияний в подслизистый слой кишки. При тяжелом поражении определяется выраженное расширение кишки.
Компьютерная томография
Более информативна, чем предыдущий метод. Выявляется отек стенки кишки, своеобразная деформация стенки кишки за счет утолщенной слизистой — симптом аккордеона (бариевый контраст остается между утолщенными кишечными складками, напоминая меха музыкального инструмента).
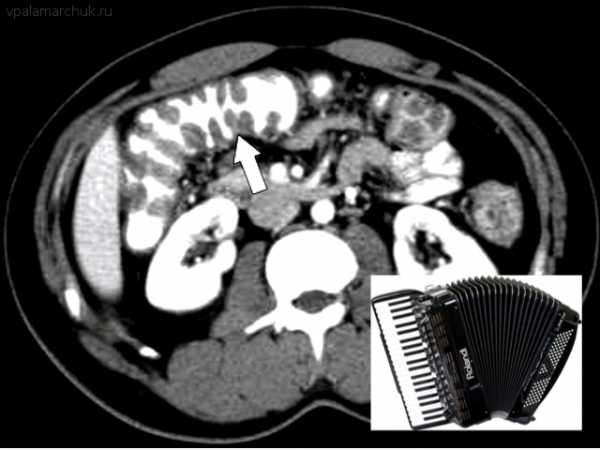
Симптом аккордеона: своеобразная «гармошка» из кишки
Отек подслизистого слоя определяется как симптом «двойного гало» или симптом двойного ореола. Вообще это признаки поражения стенки кишки не совсем специфичны, наблюдаются они и при ишемическом колите.
Лечение псевдомембранозного колита
Чаще всего псевдомембранозный колит развивается после применения клиндамицина, линкомицина, полусинтетических пенициллинов и цефалоспоринов с широким спектром антибактериального действия.
Но есть одно но. Болезнь может развиться после применения других антибиотиков, в том числе ванкомицина и метронидазола, которые как раз применяются для лечения!
После подтверждения диагноза необходимо определить ответственные антибиотики и прекратить их прием. Следующим шагом в лечении — подобрать препарат.
Выбор небольшой: метронидазол, ванкомицин и фидаксомицин. В США, например, одобрены первые два.
Метронидазол — антибактериальный препарат, который используется для лечения псевдомембранозного колита с 1970х годов. Многочисленные исследования показали, что он также эффективен, как и ванкомицин при лечении начальных и умеренных проявлений колита.
Фидаксомицин, как антибиотик группы макролидов был одобрен в 2011 году.
Выбор препарата зависит от тяжести течения колита. Легкое и умеренное лечение начинают с приема метронидазола в течение 10 — 14 дней. При отсутствии эффекта применяется ванкомицин или фидаксомицин.
Очень важно в лечении снизить к минимуму возможность рецидивов. Рецидив для псевдомембранозного колита — довольно частое и малоприятное осложнение. Сейчас есть два крупных исследования, которые продемонстрировали преимущества фидаксомицина перед ванком
vpalamarchuk.ru
Псевдомембранозный энтероколит — Википедия
Материал из Википедии — свободной энциклопедии
Псевдомембранозный колит — заболевание, вызывающееся спорообразующим анаэробным микробом Clostridium difficile. Несмотря на то что клинические проявления болезни весьма вариабельны, чаще всего у больных наблюдаются длительная диарея, интоксикация, боль в животе и лейкоцитоз, возникающие, как правило, на фоне антибиотикотерапии.
Причиной псевдомембранозного энтероколита является нерациональное применение антибиотиков, приводящее к избыточному размножению определенного условно-патогенного микроба — Clostridium difficile.
Диарея, частый водянистый стул, со слизью и кровью. Повышается температура, появляются признаки интоксикации — слабость, разбитость, тошнота, рвота. Больной жалуется на боли в животе, которые усиливаются перед дефекацией, могут быть ложные позывы, тенезмы. При объективном исследовании живот умеренно вздут, отмечается болезненность при пальпации по ходу толстой кишки. Тяжелым можно считать такое течение заболевания, когда в клинике, наряду с выраженными кишечными проявлениями, наблюдаются сердечно-сосудистые нарушения — тахикардия, гипотония; явления дегидратации и электролитные расстройства. Часто бывают признаки нарушения белкового обмена, по-видимому, вследствие экссудативной энтеропатии. Утяжеляет состояние больного развитие осложнений — перфорации кишки и токсического мегаколон. У больного с перфорацией значительно усиливаются боли, появляется локальная болезненность и напряжение мышц брюшного пресса, определяется свободная жидкость в брюшной полости, ещё более усугубляются общие расстройства.
Первым мероприятием является отмена антибиотика, спровоцировавшего развитие псевдомембранозного колита. Этиотропная терапия заключается в назначении антибактериальных средств, к которым чувствителен Сl.difficile. Это ванкомицин и метронидазол. Ванкомицин плохо всасывается в кишечнике, при пероральном приеме его концентрация быстро нарастает. Назначается по 125 мг 4 раза в день в течение 5-7 дней. Препаратом выбора является метронидазол (0,25 3 раза в день) в течение 7-10 дней. В тяжелых случаях, когда пероральный прием затруднен, метронидазол можно назначать внутривенно. Крайне важна патогенетическая терапия, особенно у больных тяжелыми формами заболевания. Основные её направления — коррекция водно-электролитных расстройств и белкового обмена, восстановление нормального состава кишечной микрофлоры, связывание токсина Cl.difficile. Прогноз всегда серьезный.
Было показано, что ректальное введение больным людям фекалий или микроорганизмов из фекалий, взятых от здоровых доноров, вылечивает системную инфекцию Clostridium difficile в 85-90% случаев[1][2][3].
Профилактика заболевания заключается в рациональном применении антибиотиков.
- ↑ Джонатан Эйзен. Знакомьтесь, ваши микробы (неопр.). TED Talks (7 января 2012).
- ↑ Burke K.E., Lamont J.T. Fecal Transplantation for Recurrent Clostridium difficile Infection in Older Adults: A Review. (англ.) // Journal of the American Geriatrics Society (англ.)русск. : journal. — 2013. — August (vol. 61, no. 8). — P. 1394—1398. — DOI:10.1111/jgs.12378. — PMID 23869970.
- ↑ Drekonja, D; Reich, J; Gezahegn, S; Greer, N; Shaukat, A; MacDonald, R; Rutks, I; Wilt, T.J. Fecal Microbiota Transplantation for Clostridium difficile Infection: A Systematic Review (англ.) // Annals of Internal Medicine (англ.)русск. : journal. — 2015. — 5 May (vol. 162, no. 9). — P. 630—638. — DOI:10.7326/m14-2693. — PMID 25938992.
ru.wikipedia.org
Псевдомембранозный колит | #02-03/99 | Журнал «Лечащий врач»
Каждое достижение в медицине имеет свою цену
Ричард К. Рут
| Слева бело-желтые бляшки в сигмовидной кишке, справа — сливающиеся бляшки, образующие псевдомембранозные поля в ободочной кишке |
Бактерии Clostridiulm difficile (КД) являются достаточно крупными (от 0,5-1,9 до 3,0-16,9 мкм) подвижными грамположительными бактериями, относящимися к группе облигатных анаэробов (род Clostridiulm), образующих в неблагоприятных условиях овальные субтерминальные споры, которые устойчивы к нагреванию и способны к длительному (в течение нескольких лет) переживанию в аэробных условиях. Температурный оптимум роста вегетативных форм — 30-37ОС. Важнейшими факторами патогенности КД являются энтеротоксин А и цитотоксин В.
- Эпидемиология
КД широко распространены в природе и имеют убиквитарное распространение, поскольку являются постоянными обитателями кишечника многих видов животных (домашних и диких), а в некоторых случаях могут обнаруживаться в испражнениях здоровых людей различных возрастных групп, включая новорожденных. В результате контаминации почвы КД могут обнаруживаться на различных объектах внешней среды, что представляет особую проблему в медицинских учреждениях. Несмотря на то что КД не относятся к патогенным бактериям, тем не менее в определенных условиях они способны вызывать такие заболевания, как антибиотикоопосредованные диареи (АОД) и псевдомембранозный колит (ПМК). Обнаружение КД на объектах внешней среды стационаров создает серьезную угрозу инфицирования пациентов. Хотя риск инфицирования при прямом контакте с бактериовыделителем или больным, как правило, невелик, однако длительный контакт может привести к развитию клинически манифестных форм инфекций, обусловленных КД (ИКД). В литературе имеются многочисленные описания внутрибольничных вспышек АОД в отделениях различного профиля [9], в том числе гериатрических, ортопедических, хирургических и пр., что позволяет говорить об ИКД как о нозокомиальной инфекции. Теоретически в отделениях любого профиля может быть зарегистрирована вспышка ИКД, однако наблюдения показывают, что наибольшему риску инфицирования КД подвергаются больные хирургических отделений и палат интенсивной терапии [7, 10]. Достаточно четко прослеживается следующая закономерность: чем более интенсивно используются инвазивные методы диагностики и лечения и агрессивная терапия, тем выше риск развития ИКД. Как показывают эпидемиологические исследования, удельный вес внутрибольничных инфекций, обусловленных КД, постоянно растет, особенно в тех странах, где налажена соответствующая лабораторно-диагностическая база [4].
Контролировать ситуацию с внутрибольничным инфицированием пациентов КД достаточно сложно. Во-первых, контроль за обсемененностью спорами КД объектов внешней среды в стационарах не проводится, во-вторых, споры КД резистентны к действию стандартных дезсредств.
Как показывают наблюдения, от 3 до 6% здоровых людей являются носителями КД. Здоровые дети первого года жизни, в том числе и новорожденные, являются носителями КД гораздо чаще — в 30-90%, хотя развитие ПМК в данной возрастной группе нетипично. В стационарах частота выявления бактерионосителей КД может быть выше. При этом у бактерионосителей, как правило, отсутствуют какие-либо клинико-лабораторные указания на развитие ИКД в анамнезе.
Сам по себе факт инфицирования пациентов КД не является определяющим в развитии ИКД. Условиями, необходимыми [4] для развития ИКД, в том числе и ПМК, являются:
- наличие источника инфицирования;
- оральный прием антибиотиков или других групп препаратов, способных вызвать нарушение микробиоценоза кишечника;
- колонизация слизистой толстой кишки КД и выработка экзотоксинов;
- индивидуальные факторы риска: возраст, предшествующие заболевания и госпитализации, длительность заболевания.
Критическим фактором для развития ИКД, в том числе и ПМК, является снижение колонизационной резистентности кишечника, в частности толстой кишки, как следствие нарушения микробиоценоза. Особенность микробной экологии толстой кишки — это абсолютное доминирование в ней анаэробных бактерий, находящихся в соотношении с аэробами 1000:1 и плотностью популяции около 1012 микробных тел на 1 г фекалий. Несмотря на столь высокий популяционный уровень индигенной микрофлоры в толстой кишке, данный микробиоценоз легко нарушается, особенно под действием антибиотиков или других внешних факторов, а восстанавливается исключительно медленно [1, 2].
| Псевдомембранозный колит (ПМК) — это редкое, но опасное заболевание, вызывающееся спорообразующим анаэробным микробом Clostridiulm difficile. Несмотря на то что клинические проявления ПМК весьма вариабельны, чаще всего у больных наблюдаются длительная диарея, интоксикация, боль в животе и лейкоцитоз, возникающие, как правило, на фоне антибиотикотерапии |
Важнейшим и наиболее мощным ко-фактором, способствующим развитию ИКД, является использование антибиотиков. Антибиотикотерапия предшествует развитию ПМК в 60-85% случаях. Несмотря на то что ИКД может быть спровоцирована практически любыми антибиотиками и/или антимикробными препаратами, включая сульфаниламиды и метронидазол, чаще всего развитие ИКД отмечается на фоне приема цефалоспоринов III поколения, клиндамицина, ампициллина, амоксициллина с клавулановой кислотой, фторхинолонов. Макролиды и рифампицин достаточно редко выступают в роли ко-факторов в развитии ИКД. Следует помнить, что ни доза, ни кратность, ни даже способ введения препарата не влияют на возможность развития ИКД. Были случаи, когда даже однократное введение антибиотика приводило к развитию АОД и ПМК.
Кроме того, описаны случаи развития ИКД, в том числе и ПМК, при использовании химиотерапии, антинеопластических препаратов, иммуносупрессивной терапии, препаратов золота, нестероидных противовоспалительных средств, антидиарейных препаратов, нейролептиков. Нарушение микроэкологии кишечника, сопровождающееся колонизацией КД, встречается при обширных операциях на брюшной полости, длительном использовании назогастральных зондов и клизм, у пациентов реанимационных отделений и отделений интенсивной терапии, при почечной недостаточности и некоторых других состояниях.
Практика показывает, что особенно часто ИКД выявляется в хирургических стационарах, особенно у больных, перенесших операцию на кишечнике. Данное обстоятельство может иметь только одно объяснение: помимо того что обширные хирургические операции сами по себе могут способствовать развитию ИКД, такие больные более чем в 90% получают антибиотики широкого спектра действия, как с целью лечения, так и профилактики. И все же примерно у 10-11% хирургических больных ИКД развивается без предварительного приема антибиотиков.
Исследования канадских авторов [3] показали, что наиболее серьезную проблему АОД представляют в больницах с числом коек более 200, в которых уровень заболеваемости ИКД составляет от 30,8 до 40,3 случая на 100 тыс. больных. Согласно другим наблюдениям [10], ПМК развивается у амбулаторных больных при получении оральных антибиотиков с частотой один-три случая на 100 тыс. больных, а среди госпитализированных частота развития ПМК составляет один на 100 (в зависимости от профиля стационара).
Таким образом, многие исследователи заключают, что КД является ведущим клинически значимым патогеном, ответственным за развитие нозокомиальных диарей, на долю которых приходится от 20 до 45% всех внутрибольничных диарей [8].
Хотя КД могут обнаруживаться в стуле здоровых людей, имеются убедительные данные, свидетельствующие о том, что эти микроорганизмы не способны к длительному существованию в неизмененной нормальной микроэкосистеме кишечника. Фактором, способствующим колонизации КД толстой кишки, является глубокое угнетение анаэробной части индигенной микрофлоры кишечника.
Ведущими факторами патогенности КД являются токсические субстанции, вырабатываемые КД: токсин А (ТА) и токсин В (ТВ), которые in vivo проявляют синергизм действия [6]. ТА — это мощный энтеротоксин с цитотоксической активностью, вызывающий нарушение барьерной функции слизистой кишечника за счет повреждения эпителиоцитов и активацию секреции жидкости в просвет кишечника. ТВ — в 1000 раз более мощный цитотоксин, чем ТА, однако его цитотоксический эффект обусловлен нарушением полимеризации внутриклеточных филаментов актина. Пикограмм ТВ способен оказывать цитопатический эффект. Выявляемые в толстой кишке морфологические изменения слизистой обусловлены действием только токсинов, поскольку сами КД не обладают инвазивными свойствами и, как правило, в подслизистый слой не проникают. Протяженность и глубина морфологических изменений, выявляемых в толстой кишке, обусловливают тяжесть течения инфекционного процесса.
Несмотря на то что ИКД чаще всего развивается после лечения антибиотиками, тем не менее взаимодействие между защитными факторами организма, внешней средой и КД остается в значительной степени мало изученным, в силу чего многие стороны патогенеза до сих пор не ясны.
Спектр клинических проявлений ИКД варьирует в широких пределах: от бессимптомного носительства и самокупирующейся диареи до тяжелых колитов. Так как ПМК представляет собой крайнюю форму проявления ИКД с возможным рецидивирующим течением, часто неблагоприятным прогнозом и требует особо сложного лечения, наибольшее внимание врачи уделяют именно этой форме заболевания. В табл. 1 представлены факторы риска развития колита, обусловленного КД.
|
Средний возраст заболевших составляет 58-60 лет, хотя развитие ИКД принципиально не зависит от возраста больных [5]. Исключение составляют новорожденные и дети до года, у которых развитие ИКД является нетипичным, и это несмотря на то, что частота обнаружения в кишечнике токсигенных штаммов КД у них намного выше, чем у взрослых. Парадокс данной ситуации объясняется тем, что в данной возрастной группе в кишечном эпителии отсутствуют рецепторы для токсинов КД.
Для АОД характерно развитие диарейного синдрома (ДС) на фоне антибиотикотерапии, при этом общее состояние больных, как правило, не изменяется. Температура тела остается на исходном уровне, могут беспокоить небольшие боли в животе, стул умеренно водянистый. Диарейный синдром носит непродолжительный характер и купируется в течение одного-трех дней после прекращения антибиотикотерапии без дополнительного лечения. Установить истинное число больных с АОД, обусловленными КД, достаточно трудно, поскольку это состояние протекает легко, без выраженного обезвоживания и, как правило, заканчивается спонтанным выздоровлением.
Клиническая картина ПМК весьма вариабельна, поскольку данное заболевание осложняет течение основного патологического процесса. Типичными для ПМК являются жидкий стул, боль в животе и лихорадка. Степень выраженности этих признаков может широко варьировать. ПМК развивается, как правило, либо непосредственно на фоне проводимой антибиотикотерапии, либо через семь — десять дней (в редких случаях позже) после прекращения антибиотикотерапии.
|
В клинической картине ПМК доминирует ДС, который в отдельных случаях бывает единственным проявлением заболевания. ДС, будучи наиболее постоянным клиническим признаком ПМК, в дебюте заболевания выявляется в 100% случаев. В отдельных случаях манифестация заболевания может начинаться с лихорадки. Частота дефекаций в сутки достигает пяти и более раз, доходя иногда до 20-30. Стул, как правило, водянистый, небольшого объема, но, учитывая кратность дефекаций, у больных могут развиваться водно-электролитные расстройства разной степени выраженности. Диарея носит упорный характер и может сохраняется до восьми — десяти недель. В отдельных случаях расстройство стула может носить перемежающий характер, когда диарея сменяется оформленным стулом, сохраняющимся в течение одного-двух дней. Часто стул содержит примесь слизи, тогда как примесь крови не характерна. Рвота встречается достаточно редко и выявляется в более поздние сроки заболевания, свидетельствуя о тяжести его течения.
Фактически одновременно с ДС у больных выявляются боли в животе разной интенсивности, преимущественно спастического характера, которые усиливаются при пальпации живота. Чаще всего боль не имеет четкой локализации и определяется по ходу кишечника.
В большинстве случаев температура тела у больных с ПМК держится на фебрильных цифрах, однако в последние годы участились случаи заболевания, при которых регистрируется гектическая лихорадка, превышающая 40°С.
Характерным для ПМК является достаточно выраженный лейкоцитоз периферической крови, достигающий 15х109/л, а в ряде случаев выявляются даже лейкемоидные реакции, при которых количество лейкоцитов может достигать 40х109/л. Имеются отдельные наблюдения, когда ПМК у больных развивается на фоне лейкопении. Как правило, лейкопения регистрируется у больных, получавших химиотерапию по поводу злокачественных опухолей. ПМК у таких больных протекает исключительно тяжело и часто носит фульминантное течение с развитием бактериемии. Именно фульминантное течение ПМК представляет наибольшую трудность в плане диагностики в силу необычности выявляемой клинической симптоматики, поскольку в этом случае наблюдается комбинированное поражение толстого и тонкого кишечника.
Для фульминантного течения ПМК характерно быстрое прогрессирование процесса. ДС, являющийся ключевым для АОД при фульминантном течении ПМК, может отсутствовать. Почти у половины больных регистрируются запор и признаки кишечной непроходимости. У таких пациентов выявляются признаки “острого живота”, лихорадка бывает выше 38,4ОС [9]. При компьютерной томографии брюшной полости выявляется асцит и значительное утолщение стенки толстой кишки. Несмотря на отчетливые клинические признаки “острого живота”, свободный воздух в брюшной полости не определяется. Особенностью ведения таких больных является то, что базисная медикаментозная терапия оказывается малоэффективной и требуется радикальное хирургическое вмешательство (субтотальная колэктомия). Летальность при фульминантном течении ПМК достигает 58%.
Учитывая длительный и упорный характер диареи, у больных с ПМК часто выявляются тяжелые электролитные расстройства (гипокалиемия), гиповолемия, снижение плазменного уровня альбуминов, развитие отеков вплоть до анасарки, гипотензия.
ПМК может осложняться развитием токсического мегаколона, перфорацией толстой кишки с развитием перитонита, инфекционно-токсическим шоком.
Рецидивирующее течение ПМК наблюдается в 20% у больных с первично установленным диагнозом после проведения стандартной антибиотикотерапии. Для больных, у которых выявлен хотя бы один рецидив, риск рецидивирующего течения ПМК возрастает до 45-68%. Механизм формирования рецидивирующего течения ПМК до сих пор до конца не выяснен. Полагают, что основной причиной является неполная санация кишечника от спор КД, хотя не исключается возможность реинфицирования.
Факторы риска развития рецидивирующего течения ПМК представлены в табл. 2.
Диагностика ИКД — это сложная проблема. Выделение возбудителя хоть и представляется важным, но имеет второстепенное значение в связи с медленным ростом бактерий. Важнейшим методом верификации диагноза ПМК является обнаружение токсинов КД в стуле. Токсигенные штаммы КД, вызывающие развитие ПМК, вырабатывают, как правило, оба токсина, однако “золотым стандартом” в диагностике ПМК может служить обнаружение ТВ при тестировании культуры клеток, которое представляет собой наиболее чувствительный метод. Предлагаемые коммерческие наборы ИФА по обнаружению токсинов А и В, к сожалению, уступают по специфичности и чувствительности цитотоксическому тесту. В последние годы разрабатываются методы ПЦР как альтернатива цитотоксическому тесту. Как показывают многие исследования, латекс-агглютинация, используемая для диагностики ИКД, на сегодня не может быть рекомендована как “базовый” метод диагностики, поскольку обладает достаточно низкой чувствительностью.
Не утратили своего диагностического значения эндоскопические методы. Патологические изменения локализуются преимущественно в дистальном отделе толстой кишки, и для их выявления достаточно провести сигмоидоскопию, однако у одной трети больных патологические изменения локализуются только в проксимальной части толстой кишки; в этом случае требуется проведение колоноскопии. Тонкий кишечник также может вовлекаться в патологический процесс, однако данный факт выявляется только на аутопсии. При сигмоидоскопии и колоноскопии отмечают диффузную гиперемию и отечность слизистой кишечника с утолщением стенки кишки, хотя в стенке кишки выявляется незначительная воспалительная реакция, а в подслизистом слое — скопление лимфоцитов. На поверхности обнаруживают характерные фибринозные бляшки желтовато-белого цвета в диаметре от 2 мм до 2 см и более (см. рис.), покрывающие язвы слизистой кишечника. Эти бляшки могут сливаться, образуя псевдомембранозные поля. Псевдомембраны обнаруживаются между прямой кишкой и левым изгибом ободочной кишки, но может поражаться и поперечная ободочная кишка. Гистологическое исследование показывает, что бляшки состоят из фибрина, муцина, слущенных эпителиальных клеток, разрушенных лейкоцитов и микробной флоры толстого кишечника.
Характер и объем проводимых терапевтических мероприятий у больных с ИКД определяется клиническим вариантом заболевания.
Асимптоматическое носительство, как правило, не требует специальных методов лечения.
При установлении диагноза ПМК лечение начинают незамедлительно. Прежде всего, если заболевание развилось на фоне антибиотикотерапии, необходима ее отмена.
Проводимая больным ПМК терапия преследует две основные цели: во-первых, необходимо купировать воспалительный процесс в кишечнике и, во-вторых, санировать кишечник от спор КД [4, 10].
Несмотря на то что антибиотики чаще всего служат причиной развития ИКД, именно антибактериальная терапия является неотъемлемой частью стандартной базисной терапии ПМК, проведение которой ограничивает колонизацию кишечника КД и купирует воспалительные изменения в кишечнике.
КД in vitro проявляют различную чувствительность к антибиотикам, однако наиболее стабильная чувствительность наблюдается к ванкомицину и метронидазолу. Обязательным условием проведения этиотропной терапии у больных с ПМК является энтеральное введение антибиотиков, поскольку при парентеральном их введении в кишечнике не создается достаточной концентрации и санации организма не наступает.
Несмотря на то что ванкомицин обычно назначают в дозе по 500 мг, проведенные исследования показывают, что дозы 125 мг четыре раза в день бывает вполне достаточно для купирования воспаления. В силу ограниченной доступности ванкомицина более широко используется метронидазол, который назначается в дозе 250–500 мг три-четыре раза в сутки. Оральный прием метронидазола в большинстве случаев эквивалентен ванкомицину, который предпочтителен в тяжелых случаях ПМК. Курс лечения антибиотиками составляет 10 дней. Если невозможен оральный прием препаратов, их вводят через назогастральный зонд. В редких случаях, при тяжелом течении ПМК, возможно комбинированное назначение ванкомицина (per rectulm) и метронидазола (внутривенно), но следует помнить, что внутривенное введение препаратов менее эффективно.
В качестве базисной антибактериальной терапии может использоваться и бацитрацин, однако в силу вариабельности и нестабильности фармакологического эффекта на КД предпочтение отдают метронидазолу и ванкомицину.
| Патоморфологические изменения при ПМК выявляются преимущественно в толстой кишке и характеризуются диффузной гиперемией, а также отечностью слизистой кишечника с утолщением стенки кишки и образованием характерных фибринозных налетов в виде бляшек желтовато-белого цвета |
Базисная антибактериальная терапия способствует достаточно быстрому купированию клинических проявлений заболевания: нормализация температуры наступает, как правило, уже в течение 24–48 часов, а частота и характер стула восстанавливается на 1–13-й день (в среднем 4,5 дня).
Были случаи, когда при неэффективности антибактериальной терапии у больных с ПМК использовался нормальный человеческий иммуноглобулин (ИГ) для внутривенного введения в дозе 200-300 мг/кг веса. Основанием для назначения данного препарата явились контрольные исследования, показавшие, что препараты ИГ содержат антитела против ТА и ТВ в концентрации 0,4-1,6 мг/мл IgG. На фоне проводимой терапии у больных регистрируется быстрое прекращение диареи, купирование болей в животе и нормализация температуры.
К сожалению, какой бы курс антибиотиков нами ни использовался, ни один из них не гарантирует полную санацию кишечника от спор КД, что создает угрозу для развития рецидивирующего течения ПМК [2]. Доказана высокая эффективность препаратов на основе непатогенных дрожжей Saccharomyces boulardii (СБ) для санации организма от спор КД. На основании большого количества наблюдений можно сделать вывод, что терапевтический эффект СБ проявляется как при сочетанном их назначении с антибиотиками, так и при проведении самостоятельного курса после антибиотикотерапии. Механизм действия СБ до конца не выяснен. Установлено, что они ингибируют рост КД, уменьшают образование и накопление цитотоксина в кишечнике, ингибируют кишечные эффекты токсинов за счет протеолиза самих токсинов и ингибирования связывания токсинов с рецепторами. Наиболее высокая клиническая эффективность СБ установлена преимущественно у больных с рецидивирующим течением ПМК. Как показывают наблюдения, не следует использовать СБ при первом эпизоде ПМК. СБ назначают по 1 г в сутки в течение четырех недель.
Эффект от использования энтеросорбентов и ионообменных смол (например, холестирамина, холестипола), несмотря на их способность связывать токсины КД, многими клиницистами оценивается как весьма скромный.
У больных с фульминантным течением ПМК базисная терапия часто оказывается малоэффективной, поэтому в таких случаях проводят хирургическое лечение [9]. Абсолютным показанием к хирургическому лечению (колэктомия с илеостомой) является наличие признаков перитонита.
Литература1. Бондаренко В. М., Учайкин В. Ф., Мурашова А. О., Абрамов Н. А. Дисбиоз. М., 1995.
2. Малов В. А., Бондаренко В. М., Пак С. Г. Роль Cloctridiuln difficile в патологии человека // Журн. микробиол.1996. № 1. С. 91-96.
3. Alfa M. J., Dul T., Beda G. Sulrvey of incidence of Clostridiulm difficile infection in Canadian hospitals and diagnostic approaches// J. Clin. Microbiol. 1998. V. 36. P. 2076-2080.
4. Bartlett J. G. Clostridiulm difficile: clinical consideretion // Rev. Infect. Dis. 1990. V. 12. Sulppl. 2. P. S243-S251.
5. Bolton R. P., Thomas D. F. Pseuldomembranouls colitis in children and adults // Br. J. Hosp. Med. 1986. V. 35. P. 37-42.
6. Branka J. E. et al. Early fulnctional effects of Clostridiulm difficile toxin A on hulman colonocytes // Gastroenterology. 1997. V .112. № 6. P. 1887-1894.
7. Bulstrode N.W. et al. Clostridiulm difficile colitis after aortic sulrgery // Eulr. J. Vasc. Endovasc. Sulrg. 1997. V. 14. № 3. P. 46-84.
8. Hulghes J. M., Jarvis W. R. Nosocomial gastrointestinal infection // In R. P. Wenzel (ed) Prevention and control of nosocomial infection. The Williams & Wilkins Co. Baltimore, 1987. P. 405-439.
9. Medich D. S., Lee K., Simmons R.L. et al. Laparotomy for fulminant pseuldomembranouls colitis // Arch. Sulrg. 1992. V .127. № 7. P. 847-852.
10. Stergachis A. Perara D. R., Schnell M. M. et al. Antibiotic-associated colitis // West. J. Med. 1984. V. 40. P. 217-219.
Историческая справка
ПМК впервые был описан американским хирургом J. Finney в 1893 году у молодой женщины, прооперированной по поводу опухоли пилорической части желудка. У пациентки развилась тяжелая диарея, повлекшая смерть на 15-й день. На аутопсии в кишечнике были обнаружены дифтеритические мембраны, что, собственно, и послужило основанием для введения данного термина. В “доантибактериальную эпоху” ПМК выявлялся у больных крайне редко и диагноз устанавливался только при аутопсии. С внедрением антибиотиков в повседневную клиническую практику проблема ПМК обострилась, поскольку количество таких больных резко возросло.
В 1965 году S. Goulstone и V. McGovern, анализируя анатомо-гистологические изменения, обнаруживаемые у больных с ПМК в кишечнике, высказали предположение, что данное заболевание вызывается неизвестным токсическим агентом, действующим локально. В 1969 году J. Small установил, что у лабораторных животных, получающих линкомицин гидрохлорид, развивается типичная патоморфологическая картина ПМК, что и явилось в последующих исследованиях лабораторной моделью изучения ПМК. R. Green в 1974 году выявил цитотоксичность в культуре клеток содержимого кишечника лабораторных животных, получавших антибиотики — это позволило предположить, что в развитии цитотоксического эффекта играет определенную роль неизвестный вирус. Установление зависимости развития диареи и/или колита на фоне использования антибиотиков послужило основанием для широкого использования в клинической практике термина “антибиотико-опосредованные диареи (колиты)”.
Несмотря на то что I. Hall и E. O’Toole впервые обнаружили Clostridiulm difficile в кишечном содержимом людей в 1935 году, их этиологическая роль в развитии ПМК и антибиотико-опосредованных диарей (АОД) была установлена только во второй половине 70-х годов.
www.lvrach.ru
Псевдомембранозный колит – причины, симптомы, диагностика и лечение
Псевдомембранозный колит – это острое воспаление толстого кишечника, вызываемое условно патогенными клостридиями и возникающее на фоне приема антибиотиков или (реже) других лекарственных средств. Клинические проявления могут варьировать. Обычно выявляются боли в животе и продолжительная диарея в сочетании с признаками общей интоксикации. В тяжелых случаях возможны грубые повреждения кишечной стенки, выраженные расстройства обмена и летальный исход. Заболевание диагностируется на основании симптомов, данных осмотра, анализов крови и кала, эндоскопического исследования. Лечение – отмена антибиотика, диета, этиотропная терапия, коррекция обменных нарушений.
Общие сведения
Псевдомембранозный колит – тяжелое осложнение приема антибиотиков, реже лечения препаратами других групп, в результате которого у больного развивается специфический дисбактериоз, сопровождающийся воспалением толстого кишечника с образованием характерных пленок на слизистой оболочке. Дисбактериоз и воспаление слизистой вызывают анаэробные грамположительные бактерии Clostridium difficile. В тяжелых случаях псевдомембранозный колит сопровождается выраженной интоксикацией, повреждениями стенки кишечника вплоть до перфорации, общей дегидратацией и грубыми электролитными расстройствами, нередко – в сочетании нарушениями белкового обмена. Возможен летальный исход. Лечение осуществляют специалисты в области клинической проктологии и гастроэнтерологии.
Псевдомембранозный колит
Причины
Причиной псевдомембранозного колита является нарушение нормальной кишечной микрофлоры, сопровождающееся избыточным размножением условно патогенной бактерии Clostridium difficile. В подавляющем большинстве случаев дисбактериоз, предшествующий развитию псевдомембранозного колита, возникает на фоне приема антибиотиков, однако в отдельных случаях состав микрофлоры кишечника может меняться под влиянием цитостатиков, иммуносупрессоров и слабительных средств.
Чаще всего псевдомембранозный колит вызывают такие антибиотики, как клиндамицин, амоксициллин, ампициллин, линкомицин и препараты из группы цефалоспоринов. Реже псевдомембранозный колит развивается при приеме левомицетина, эритромицина, тетрациклина и пенициллина. Из-за подавления микробов-симбионтов в кишечнике начинают размножаться Clostridium difficile. Эти бактерии в небольшом количестве содержатся в ЖКТ примерно у 3% населения.
Размножающиеся клостридии выделяют токсические вещества, оказывающие негативное влияние на слизистую оболочку кишечника и вызывающие развитие псевдомембранозного колита. Некоторые антибиотики усиливают повреждающее действие токсинов, что еще больше усугубляет возникшие нарушения. Стенка кишечника теряет свои барьерные свойства и начинает интенсивно секретировать жидкость в просвет кишки. Токсичные соединения всасываются в организм, вызывая развитие интоксикации. Жидкость перемещается в просвет кишечника, развивается обезвоживание, возникают электролитные расстройства.
В тяжелых случаях у больных псевдомембранозным колитом выявляются нарушения белкового обмена. Страдает сердечно-сосудистая система. Возможно формирование токсического мегаколона и прободение стенки кишечника с излитием кишечного содержимого в брюшную полость. Причиной летального исхода при псевдомембранозном колите может стать перитонит, обусловленный инфицированием брюшной полости микроорганизмами, содержащимися в каловых массах, или обезвоживание и нарушение функций различных органов и систем в результате интоксикации и грубых обменных расстройств.
Псевдомембранозный колит может рассматриваться, как внутрибольничная инфекция. Болезнь часто развивается при лечении в стационарных условиях, особенно – при пребывании в одной палате с пациентами, страдающими данной патологией. Факторами, увеличивающими вероятность развития псевдомембранозного колита и одновременно усугубляющими его течение, являются пожилой возраст, декомпенсированные соматические заболевания, болезни ЖКТ, бесконтрольный прием антацидов, почечная недостаточность, злокачественные опухоли, иммунные нарушения (в том числе – при СПИДе), ослабление организма после обширных хирургических вмешательств, а также состояния различного генеза, требующие проведения интенсивной терапии.
Симптомы колита
Клиническая картина псевдомембранозного колита определяется тяжестью патологии. При легких формах наблюдаются поносы и схваткообразные боли в животе на фоне ухудшения общего состояния организма. Стул обильный, водянистый, возможно – с примесями слизи. Общая интоксикация при псевдомембранозном колите проявляется в виде повышения температуры тела, слабости, разбитости, головной боли, тошноты и рвоты. Выраженность диареи и интоксикационного синдрома могут различаться. Все признаки исчезают после отмены антибиотиков.
При тяжелой форме болезни и псевдомембранозном колите средней степени тяжести клиническая симптоматика сохраняется в течение 1-2 и более недель после прекращения антибиотикотерапии. Пациенты страдают от изнуряющей диареи. Кал приобретает специфический вид «рисового отвара» желтоватой или зеленоватой окраски. В каловых массах больных псевдомембранозным колитом выявляются примеси слизи и крови. Потери значительных количеств жидкости с калом обуславливают развитие дегидратации и расстройств водно-электролитного обмена, проявляющихся слабостью, учащением пульса, снижением артериального давления, нарушением тонуса мышц и парестезиями. Возможны судороги. Отмечается уменьшение количества выделяемой мочи.
Отличительными особенностями тяжелой формы псевдомембранозного колита являются более бурное течение и появление крови в фекальных массах с первых дней заболевания. Наблюдается быстрое нарастание интоксикации, в сочетании с интенсивными схваткообразными болями в левой половине живота (преимущественно – в проекции сигмовидной кишки). Тяжелым осложнением псевдомембранозного колита может стать образование патологического расширения кишечника (мегаколона) с последующим разрывом кишки и развитием перитонита. О развитии мегаколона свидетельствует ухудшение состояние пациента с гипертермией до 39 градусов и выше в сочетании с уменьшением частоты дефекаций и увеличением объема живота.
У некоторых пациентов с псевдомембранозным колитом выявляется реактивный артрит. Иногда наблюдается экссудативная энтеропатия – невоспалительное поражение кишечника, сопровождающееся нарушениями белкового обмена и гипопротеиновыми отеками, обусловленными потерей большого количества белка через желудочно-кишечный тракт. Известны случаи стремительного развития псевдомембранозного колита с быстрым обезвоживанием, развитием гиперкалиемии и последующей остановкой сердца.
Диагностика
Диагноз устанавливается специалистом-проктологом или гастроэнтерологом с учетом анамнеза (прием антибиотиков или других препаратов, способных спровоцировать развитие заболевания), жалоб, данных физикального исследования и дополнительных диагностических процедур. В ходе внешнего осмотра больного псевдомембранозным колитом врач отмечает гипертермию, артериальную гипотонию, тахикардию, увеличение объема живота и болезненность при пальпации. В общем анализе крови определяется лейкоцитоз. При исследовании кала выявляются кровь и слизь. При бактериологическом исследовании фекальных масс обнаруживаются Clostridium difficile.
При проведении эндоскопического исследования у пациентов с псевдомембранозным колитом визуализируется слизистая оболочка, покрытая характерными желтоватыми фибринозными пленками (псевдомембранами). Обычно для подтверждения диагноза достаточно ректороманоскопии, поскольку псевдомембранозный колит чаще поражает дистальные отделы толстой кишки. В сомнительных случаях и при необходимости оценить состояние верхних отделов толстого кишечника проводят колоноскопию. При подозрении на развитие мегаколона назначают радиологические исследования (КТ, рентгенографию).
Лечение псевдомембранозного колита
Лечение данной патологии преимущественно консервативное. Больным отменяют антибиотики, назначают специальную диету, рекомендуют употреблять больше жидкости для предупреждения дегидратации. При легких формах псевдомембранозного колита этиотропные препараты обычно не требуются. При среднетяжелой и тяжелой форме болезни используют метронидазол. При наличии противопоказаний к применению данного препарата проводят терапию ванкомицином. Для восстановления нормальной микрофлоры кишечника назначают препараты бифидум и лактобактерий.
При тяжелых формах псевдомембранозного колита осуществляют инфузионную терапию для восстановления объема жидкости, устранения интоксикации, коррекции потерь белка и электролитных нарушений. При псевдомембранозном колите, осложненном токсическим мегаколоном, показано хирургическое вмешательство – сегментарная резекция пораженной части кишечника. Перфорация кишки является показанием к проведению неотложной операции – удалению пораженного отдела кишки, промыванию и дренированию брюшной полости для предупреждения развития перитонита.
Прогноз и профилактика
Прогноз при псевдомембранозном колите определяется тяжестью заболевания. Средняя вероятность гибели пациентов с данной патологией при отсутствии лечения составляет около 30%. При легких формах псевдомембранозного колита обычно наблюдается выздоровление после прекращения антибиотикотерапии. При колитах средней тяжести клиническая симптоматика сохраняется в течение нескольких недель, в последующем возможны рецидивы. Тяжелые формы псевдомембранозного колита часто завершаются гибелью пациентов. Шансы на благополучный исход при мегаколоне и перфорации кишечника еще больше снижаются, поскольку оперативные вмешательства приходится проводить в условиях резкого ослабления организма больного. Кроме того, перфорация толстой кишки часто осложняется перитонитом даже при раннем оперативном вмешательстве, что обусловлено наличием большого количества бактерий в кишечном содержимом.
Основной профилактической мерой является обоснованное назначение антибиотиков, выбранных с учетом индивидуальных противопоказаний, состояния больного и риска развития псевдомембранозного колита. Необходимо одновременное использование средств для предупреждения дисбактериоза, особенно – при продолжительной антибиотикотерапии. В группу высокого риска возникновения псевдомембранозного колита включают больных в возрасте старше 65 лет и пациентов, постоянно принимающих средства из группы антагонистов гистаминовых рецепторов. Больным из этой группы не рекомендуется назначать антибиотики, часто провоцирующие псевдомембранозный колит.
www.krasotaimedicina.ru
