Энтеропротекторы – Защита кишечника (Энтеропротекторы) | «Все о желудке и ЖКТ»
Защита кишечника (Энтеропротекторы) | «Все о желудке и ЖКТ»
Дефекты слизистой оболочки желудка и кишечника (микроповреждения, эрозии, язвы) могут появляться под воздействием агрессивных факторов экзогенного и эндогенного характера. Проще говоря, враг может напасть извне, а может – изнутри. У пищеварительного тракта от природы есть защитные силы, для того чтобы противостоять различным атакам. Но их не всегда хватает. В этом случае нужна подмога в виде лекарственных средств.
АГРЕССИВНЫЕ ФАКТОРЫ
Эндогенные факторы, (развивающееся из-за внутренних причин), считаются условно агрессивными: они выполняют ряд жизненно важных функций и становятся разрушителями только при определённых условиях. К ним относят желудочный сок (соляную кислоту), пепсин, липазу и желчные кислоты.
К экзогенным факторам, (возникающим под воздействием внешних причин), относят:
ЗАЩИТНЫЙ БАРЬЕР
Слизистая оболочка – это естественный высокопрочный барьер желудочно-кишечного тракта, который преграждает путь бактериям, токсинам, соляной кислоте, пепсину и другим опасным веществам.
Защита включает в себя несколько уровней:
- бикарбонаты и так называемый неактивный слизистый слой. Основная функция слизи заключается в том, чтобы концентрировать и удерживать ионы соляной кислоты на своей поверхности, затрудняя их продвижение в желудочную полость. Таким образом слизь не дает эпителиальным клеткам желудка контактировать с агрессивными агентами. Кроме того, она защищает эпителий от механических микротравм грубыми частицами пищи и удерживает в себе бактерии, не давая им проникнуть в просвет желудка и 12-перстной кишки;
- собственно эпителий. Он не только синтезирует слизь и бикарбонаты, но и сам является надежной защитной мембраной. Клетки эпителия, при попадании в них соляной кислоты, некоторое время ещё живут, а потом слущиваются, погибают и перемещаются в неактивный слой. На их место «встают» клетки-мигранты – так эпителиальный слой восстанавливается;
- микроциркуляция крови в слизистой оболочке желудка также является одним из уровней защиты ЖКТ от агрессивных агентов. Через кровь эпителий снабжается кислородом, водой, питательными и буферными веществами. Понижение кровотока может стать причиной развития ишемии слизистой. В последующем это ведет к формированию язв и некрозов в эпителии.
Если на каком-то из структурных уровней слизистой появляются микро- или макроповреждения, она перестаёт полноценно нести свою защитную функцию. Через трещины, эрозии и язвы начинают проникать болезнетворные организмы. Пищеварительная система даёт сбой, который человек ощущает через боль в животе, изжогу, нарушения стула (диарея, запор), вздутие, метеоризм и другие неприятные симптомы. В конечном счёте патологический процесс в желудочно-кишечном тракте (ЖКТ) может привести к развитию онкологии.
РОЛЬ РЕБАМИПИДА В ЭНТЕРОПРОТЕКЦИИ
Энтеропротекторы – это препараты, которые защищают слизистую в кишечном секторе пищеварительного тракта. Они отражают атаки патогенных микроорганизмов, токсинов и прочих агрессоров и параллельно восстанавливают плотные контакты клеток, помогают рубцеваться эрозиям и язвам. После лечения энтеропротекторами обновлённая слизистая сама начинает нормально нести свою барьерную функцию.
В этой линейке препаратов можно выделить ребагит (ребамипид): при высокой эффективности он практически не даёт побочных эффектов (по данным исследований, 0,54% пациентов жалуются на незначительную побочку). Кроме того, препарат работает сразу на нескольких уровнях ЖКТ: защищает слизистую в желудке, кишечнике и на всей протяжённости пищеварительного тракта. Поэтому врачи-гастроэнтерологи назначают его при гастрите и язвенной болезни.
Ребагит также устраняет микроповреждения, невидимые для эндоскопии. Как определить, что они есть? Если человека мучат постоянная болезненность в животе, изжога, чувство переполненности, плохой аппетит и сон, метеоризм и вздутие. Но стоит восстановить слизистую оболочку – и все неприятные ощущения отступят.
lechenie/zashhita-zheludka-gastroprotekcziya
vseojkt.ru
Энтеропротекторы в лечении синдрома энтеральной недостаточности при острой кишечной непроходимости различной этиологии
УГРОЖАЮЩИЕ СОСТОЯНИЯ В ПЕДИАТРИИ
БИБЛИОTЕКА НЕПРЕРЫВНОГО МЕДИЦИНСКОГО ОБРАЗОВАНИЯ Э.К. Цыбулькин УГРОЖАЮЩИЕ СОСТОЯНИЯ В ПЕДИАТРИИ Экстренная врачебная помощь 2014 Общие принципы диагностики и лечения… 11 Глава 1 ОБЩИЕ ПРИНЦИПЫ ДИАГНОСТИКИ
ПодробнееАппарат СПИНОР 8 (800)
СНИЖЕНИЕ ТОКСИЧЕСКОГО ДЕЙСТВИЯ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ ПОД ВЛИЯНИЕМ КВЧ-ТЕРАПИИ У БОЛЬНЫХ ЛИМФОМАМИ 1ГОУ ВПО «Новосибирский государственный медицинский университет Росздрава» (г. Новосибирск) 2МУЗ
Ветвитал В форте Ветвитал В
Биосупервит Ветвитал В форте Ветвитал В Интровит В комплекс Орал Мультивит Поливитаминоацидос Суправитаминол Ришко О.А., Щепёткина С.В., ГК ЗДОРОВЬЕ ЖИВОТНЫХ АНАЛИЗ РЫНКА ВИТАМИННЫХ ПРЕПАРАТОВ В СВИНОВОДСТВЕ
ПодробнееМЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Учреждение образования «Белорусский государственный медицинский университет» Кафедра поликлинической терапии ТЕМА: Болезни пищевода (ГЭРБ), желудка (функциональная диспепсия, хронический гастрит, пептическая
ПодробнееКулагин Алексей Евгениевич
кафедра анестезиологии и реаниматологии Б Г М У доцент Кулагин Алексей Евгениевич Л А К Т А Т конечный продукт анаэробного метаболизма глюкозы; большая часть метаболизируется печенью в процессе глюконеогенеза;
ПодробнееПорталак инструкция по медицинскому
Порталак инструкция по медицинскому применению препарата Регистрационный номер: П N 015059/01-051108 Торговое название препарата: Порталак Международное непатентованное название: Лактулоза Лекарственная
ПодробнееФлараксин эффективен при:
Флараксин-инъекционный – противоопухолевый, противовирусный фитопрепарат, обладающий интерферогенными свойствами, стимулирует фактор некроза опухоли, является протектором для здоровых клеток при химиотерапии.
Подробнее«Есть, для того чтобы жить, а не жить, для того, что бы есть». Все о диете.
Смекта : Инструкция по применению
Смекта : Инструкция по применению Действующее вещество: Смектит диоктаэдрический (Smectite dioctaedric) Содержание Состав Фармакологическое действие Фармакодинамика Фармакокинетика Показания Противопоказания
ПодробнееМЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Учреждение образования «Белорусский государственный медицинский университет» Кафедра поликлинической терапии ТЕМА: Диспепсический синдром и абдоминальная боль: дифференциальная диагностика и тактика участкового
ПодробнееЯЗВЫ И ГАСТРИТЫ НЕ СТРАШНЫ
ЯЗВЫ И ГАСТРИТЫ НЕ СТРАШНЫ НОВЕЙШАЯ КОЛЛОИДНАЯ ФИТОФОРМУЛА ГАСТЕРО КОМПЛЕКС ЭФФЕКТИВНЫЕ МЕТОДИКИ ПРИМЕНЕНИЯ НОВИНКА! Гастеро Комплекс эффективно облегчает тягостные ощущения, связанные с нарушением работы Подробнее1. Набор “Супер-масса. Старт”
1. Набор “Супер-масса. Старт” Подходит тем, кто только начал посещать тренажерный зал и никогда не использовал до этого комплексы спортпитания. Составляющие набора 1. Изолят соевого белка (1 кг) 2. Мальтодекстрин
ПодробнееНаследственные нарушения развития зубов 20 Заключение 35. заболевания зубов, имеется и другая разнообразная патология твердых. В возникновении же некоторых других видов поражения твердых тканей еще много.
ПодробнееОсновные свойства тыквенных семечек
Лечебные свойства тыквенных семечек Тыквенные семечки, благодаря богатому содержанию полезных микроэлементов и минералов, активно используются в терапии различных заболеваний. Кроме того, тыквенные семечки
ООО «АлексАнн» Веракол. Сборник
ООО «АлексАнн» Веракол Сборник Оглавление 1. Токсикологические исследования in vivo…2 2. Изучение эффективности препарата Веракол при гастроэнтерите собак и кошек 3 3. Изучение эффективности использования
ПодробнееПредупреждение онкологических
Предупреждение онкологических Предупреждение онкологических Многочисленные исследования доказывают, что риск возникновения многих во взрослом возрасте связан с тем, подвергался ли человек в детском возрасте
ПодробнееВрачебный диагноз
Врачебный диагноз 1 Диагноз это определение существа и особенностей болезни на основе всестороннего исследования больного («Российский энциклопедический словарь») 2 Диагноз (греч. diagnōsis распознавание)
ПодробнееБаза нормативной документации:
М Е Ж Г О С У Д А Р С Т В Е Н Н Ы Й С Т А Н Д А Р Т Система стандартов безопасности труда БИОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ Общие требования ГОСТ 12.1.008-76 Occupational safety standards system. Biological safety.
ПодробнееМИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ ВГУЗУ «Украинская медицинская стоматологическая академия» “Утверждено” на заседании кафедры внутренней медицини 1 Заведующая кафедрой Доцент Маслова А.С. Протокол 17
ПодробнееСтатистические данные по аппендициту
Настоящая статья основана на опыте лечения детей с неосложненным острым аппендицитом в клинике детской хирургии, урологии и эндоскопии Новокузнецкого ГИДУВа. В течение последних лет в клинику было направлено
ПодробнееБИОФОН Коррекция общего дисбиоза
БИОФОН Коррекция общего дисбиоза Здоровье каждого из нас зависит от баланса между дружественными микроорганизмами и паразитами. Именно соотношение этих положительных и вредоносных фракций определяет понятия
ПодробнееRebound fx Citrus Punch. Ребаунд fx
Rebound fx Citrus Punch Ребаунд fx Для чего нужно спортивное питание? Дает приток энергии Повышает выносливость Усиливает защитные силы организма Ускоряет и облегчает восстановительный период после нагрузок
Подробнееdocplayer.ru
новый взгляд на диагностику и лечение болезней тонкой кишки uMEDp
В статье приведены классификация энтеропатий, методы лабораторно-инструментальной диагностики и алгоритм дифференциальной диагностики. Изложены принципы этиотропной, патогенетической и симптоматической терапии.
Рис. 1. Микрофотография. Коллагеновая спру (пласт коллагеновых волокон под базальной мембраной. Окраска по Ван Гизону): а – поверхностный эпителий, б – пласт коллагеновых волокон, в – крипта
Таблица 1. Наиболее известные ЭП
Рис. 2. Микрофото. Болезнь Уиппла. Отечная ворсинка слизистой оболочки тонкой кишки с PAS-включениями. PAS-реакция
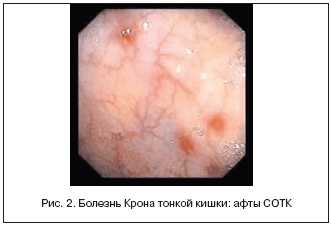
Рис. 3. Болезнь Крона тонкой кишки: афты СОТК
Рис. 4. Микрофото. Лимфангиэктазия. Окраска гематоксилином и эозином
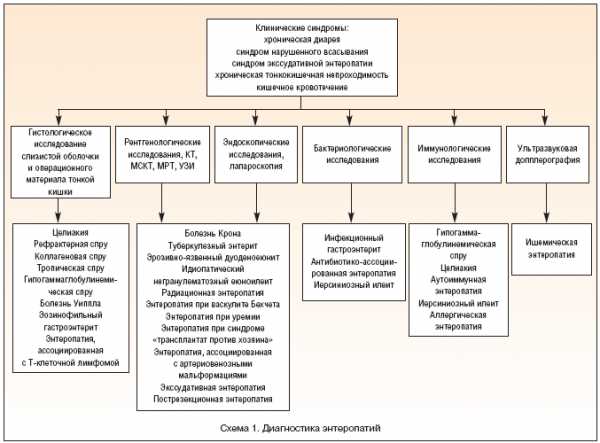
Рис. 5. Диагностика ЭП
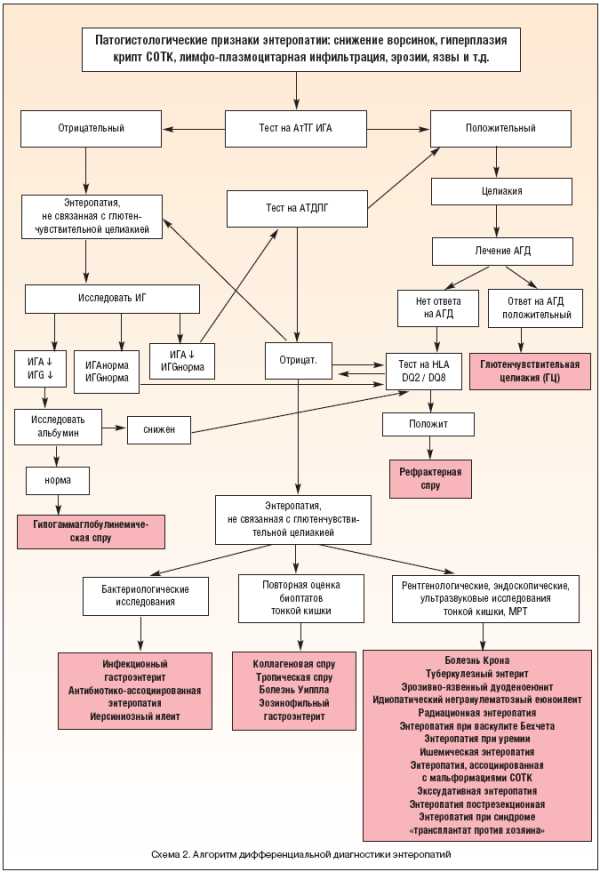
Рис. 6. Алгоритм дифференциальной диагностики ЭП
Таблица 2.Терапия ЭП
Энтеропатии (ЭП) – общее название болезней, объединяемых патологическими (воспалительными, геморрагическими эрозивно-язвенными и атрофическими) изменениями тонкой кишки. Современные методы исследования позволяют получить информацию о патоморфологических и функциональных изменениях кишки, однако из-за их сходства при многих нозологических формах дифференциальная диагностика ЭП остается одной из сложных в клинике внутренних болезней. В таблице 1 представлены наиболее известные ЭП и вызывающие их этиологические факторы. Из таблицы 1 видно, что ЭП могут быть известной и неизвестной этиологии, первичными и вторичными, связанными с патологией других органов и систем, острыми (инфекционными, токсическими, аллергическими) и хроническими. К ЭП известной этиологии (специфические) относятся глютенчувствительная целиакия (ГЦ), ЭП, вызываемые бактериями, вирусами, грибами и паразитами, лекарствами (нестероидные противовоспалительные препараты – НПВП, антибиотики и др.), пищевыми аллергенами. ЭП могут вызывать физические факторы (радиация, токсины), аномалии развития и приобретенные нарушения проходимости артериовенозных и лимфатических сосудов (мальформации), васкулиты, болезни печени, почек, крови, соединительной ткани, эндокринной и иммунной системы. Правильно установленный нозологический диагноз при ЭП известной этиологии позволяет добиться выздоровления с восстановлением структуры слизистой оболочки тонкой кишки (СОТК) или глубокой клинико-морфологической ремиссии при условии исключения влияния этиологического фактора и выполнения оптимальной программы лечения [1]. Наиболее тяжелыми и прогностически сомнительными являются ЭП неизвестной этиологии, то есть неспецифические. К ним относятся целиакия, нечувствительная к глютену (рефрактерная), гипогаммаглобулинемическая спру (ГГГС), коллагеновая спру, аутоиммунная ЭП с образованием антител к энтероцитам, гранулематозный энтерит (болезнь Крона), идиопатический негранулематозный еюноилеит, эозинофильный гастроэнтерит, ЭП, развивающаяся при реакции «трансплантат против хозяина». Хотя причины этих ЭП остаются неизвестными, механизмы понимания патологического процесса находятся на молекулярном уровне, а биологическая терапия настолько эффективна в подавлении воспаления, что конечной точкой ремиссии может быть достижение полного восстановления структуры и функции тонкой кишки. Патоморфология Патоморфология ЭП не имеет строго патогномоничных нозологических критериев. Тем не менее патогистологическая картина ГЦ, болезни Уиппла, ГГГС, коллагеновой спру, гранулематозного илеита Крона и некоторых других позволяет установить точный нозологический диагноз. Для ГЦ характерно снижение высоты ворсинок (атрофия), углубление (гиперплазия) крипт, инфильтрация лимфоцитами и плазмоцитами собственной пластинки и эпителиоцитов (межэпителиальные лимфоциты – МЭЛ). Исключение из пищевого рациона растительного белка глютена, содержащегося в пшенице, ржи и ячмене, приводит к постепенному восстановлению СОТК. Если лечение не оказывает заметного влияния на СОТК, то речь должна идти о рефрактерной форме целиакии. Различают 2 типа рефрактерной целиакии. При 1-м типе СОТК инфильтрирована нормальным лимфоплазмоцитарным фенотипом. При 2-м типе МЭЛ представлены аберрантным клоном лимфоцитов, предрасположенных к развитию Т-клеточной лимфомы. При ГГГС структура СОТК сходна с таковой при ГЦ, но отличается почти полным отсутствием в инфильтрате плазматических клеток, продуцирующих основные классы иммуноглобулинов (Ig). При коллагеновой спру СОТК также атрофирована, а под базальной мембраной энтероцитов образуется слой коллагена, существенно нарушающий пищеварительно-транспортную функцию тонкой кишки (рис. 1). Лечение больных ГГГС и коллагеновой спру аглютеновой диетой (АГД) не оказывает влияния на СОТК. К редким формам относится аутоиммунная ЭП. Для нее характерны хроническая диарея, тяжелый синдром нарушенного всасывания, сходная с целиакией атрофия ворсинок и гиперплазия крипт, лимфоплазмоцитарная инфильтрация собственной пластинки СОТК с повышенным количеством МЭЛ. У некоторых снижен IgА. Патогенез аутоиммунной ЭП связан с появлением антител к собственным энтероцитам. Больные не отвечают на лечение АГД, течение болезни отличается плохим прогнозом. При болезни Уиппла в макрофагах собственной пластинки СОТК поселяются бактерии Уиппла (Tropheryma whippelii). Скопления макрофагов, заполненных PAS-положительными гранулами бактериального происхождения, служат диагностическими маркерами болезни Уиппла (рис. 2). Их находят также в лимфатических сосудах тонкой кишки и других органов у пациентов с нарушенной функцией макрофагов, не отвечающих на присутствие бактерий выработкой специфических антител. В результате развивается синдром экссудативной ЭП, поражение суставов, нервной системы и других органов. Болезнь Крона (БК) характеризуется развитием воспаления стенки кишки с формированием гранулем в подслизистом слое, содержащих гигантские эпителиоидные клетки Пирогова – Лангханса. Уже на ранней стадии появляются поверхностные язвы (афты) (рис. 3), которые не являются специфическими и отражают лишь тяжесть воспалительной реакции и ее длительность. В редких случаях язвенный еюнит (илеит) развивается без гранулематозного воспаления и классифицируется как негранулематозный еюноилеит неизвестной этиологии. Экссудативная ЭП может быть первичной (вследствие аномалии развития) и вторичной. Вторичный синдром экссудативной ЭП развивается в результате механической или функциональной блокады лимфатического аппарата кишечника воспалительной или опухолевой природы. Он может сопутствовать болезни Уиппла, васкулитам, правожелудочковой сердечной недостаточности. Гистологическими признаками экссудативной ЭП служат ворсинки, заполненные лимфой. В собственной пластинке СОТК видны расширенные лимфатические сосуды, приобретающие вид лимфатических «озер» (рис. 4). Клиническая картина Клиническая картина ЭП характеризуется хронической диареей, симптомами мальабсорбции и аутоиммунными нарушениями. Болевой синдром отсутствует или незначителен, но при нарушении проходимости тонкой кишки может стать ведущим в клинической картине. При инфекционной ЭП диарея водянистая, является следствием избыточной секреции воды и электролитов в просвет кишки. Основные активаторы секреции – бактериальные токсины, вирусы, лекарства и биологически активные вещества. В механизме диареи при мальабсорбции ведущую роль играет повышение осмотического давления неабсорбированного химуса, вызывающего задержку воды в просвете кишки. Стул становится обильным с большим количеством продуктов гидролитического расщепления нутриентов. При исследовании крови часто выявляется микроцитарная, или В12-дефицитная, анемия, вызванная снижением всасывания железа, витамина В12 и фолиевой кислоты. Уменьшение в сыворотке крови ионов калия, кальция, магния и хлора, белка и холестерина указывает на их плохое всасывание в тонкой кишке. В патогенезе диареи при БК, инфекционных и других энтеропатий с повреждением СОТК, а также вследствие гамартий (синдромы Пейтца – Егерса и Кронкайта – Канада) преобладает экссудация воды, электролитов и белка в просвет кишки. Стул жидкий, часто с кровью и гноем. Характерны боли в животе, лихорадка, анорексия, похудение и отеки. В анализах крови наблюдается лейкоцитоз, повышенная скорость оседания эритроцитов, повышение С-реактивного белка, фекального кальпротектина, гипоальбуминемия и гипопротеинемия. БК характеризуется прогрессирующим течением. Различают три фенотипа или формы БК – воспалительную (люминальную), cтенозирующую и пенетрирующую (экстралюминальную), осложняющуюся межкишечными и иными свищами, абсцессами и инфильтратами в брюшной полости. В отличие от БК негранулематозный неспецифический еюноилеит не имеет склонности к стенозам и экстралюминальным осложнениям. Основным проявлением ЭП, ассоциированной с артериовенозными мальформациями кровеносных и лимфатических сосудов, могут быть рецидивирующие кровотечения, источником которых служат повреждения (изъязвления) артериовенозных ангиэктазий. При лимфангиэктазиях возникает избыточная потеря белка в просвет кишки. Диагноз и дифференциальная диагностика Нозологическая диагностика болезней тонкой кишки улучшается по мере усовершенствования иммунологических, рентгенологических и особенно эндоскопических методов [2]. На рисунке 5 показаны возможности каждого из них в распознавании ЭП. Основное значение для установления нозологического диагноза целиакии, коллагеновой и тропической спру, болезни Уиппла, ГГГС, эозинофильного гастроэнтерита имеет гистологическое исследование биоптатов СОТК, полученных из дистального отдела двенадцатиперстной кишки. Тем не менее надо иметь в виду, что сходная с целиакией атрофия ворсинок слизистой оболочки вблизи луковицы двенадцатиперстной кишки развивается у ряда больных кислотозависимыми заболеваниями вследствие влияния на нее пептического фактора. Диагностике ГЦ в этих случаях помогают иммунологические исследования на антитела к тканевой трансглутаминазе (АТтТГ) и антитела к диамидированному пептиду глиадина (АТДПГ), которые отсутствуют при пептических дуоденитах [3]. Атрофию ворсинок, напоминающую таковую при ГЦ, можно наблюдать и у пациентов с общим вариабельным иммунодефицитом, особенно при наличии симптомов мальабсорбции. В этом случае речь идет о ГГГС [1]. Для эозинофильного гастроэнтерита характерна эозинофильная инфильтрация стенки кишки, не имеющая отношения к аллергии пищевого или паразитарного происхождения.Сложности диагностики ГЦ объясняются также тем, что:
- атрофия ворсинок распределяется неравномерно, поэтому требуется исследовать не менее 3–5 биоптатов из дуоденальной слизистой оболочки;
- АТтТГ, характерные для ГЦ, на момент постановки диагноза могут отсутствовать [4];
- иногда СОТК восстанавливается под влиянием АГД очень медленно;
- у некоторых больных рефрактерной целиакией 2-го типа с клональной экспансией МЭЛ с аберрантным фенотипом, не отвечающих на лечение АГД, развивается Т-клеточная лимфома, ассоциированная с ЭП.
В заключение отметим, что только после исключения всех форм ЭП у пациента с хронической диареей допустимо устанавливать функциональное нарушение кишечника – функциональную диарею или синдром раздраженного кишечника при наличии соответствующих клинических критериев и отсутствии других клинических синдромов, указанных на рис. 5.
Терапия больных ЭП может быть этиотропной, патогенетической и симптоматической. В таблице 2 приведены принципы терапии. Этиотропная терапия. В основе этиотропной терапии ГЦ лежит строгая пожизненная приверженность АГД. Соблюдение этого принципа наряду с безусловно положительными влияниями несет в себе много проблем. Они связаны с ограничениями социальных и бытовых условий жизни больного. Исключение из рациона пшеницы, ржи и ячменя существенно сужает качественный состав пищевого рациона, затрудняет его обеспечение, тем более что многие из продуктов (мясные, кисломолочные и др.) содержат глютен, делает его более дорогим. В большинстве развитых стран налажена маркировка продуктов на содержание глютена. Больные получают денежные дотации. Специалисты в области пищевой промышленности работают над созданием генетически модифицированных сортов пшеницы, лишенных иммуногенных антигенных детерминант. Фармацевтическая промышленность приступила к созданию ферментных препаратов, способных расщеплять глиадин: проходит клинические испытания пролилэндопептидаза. Исследуются агенты типа октапептида АТ-1001, которые блокируют рецепторы зонулина и тем самым уменьшают проницаемость межэпителиальных соединений и приток глютена в собственную пластинку СОТК. Больным аллергическим гастроэнтеритом из рациона исключают пищевые аллергены. При болезни Уиппла применяют диету, бедную длинноцепочечными и обогащенную среднецепочечными триглицеридами, которые содержатся в продуктах энтерального питания (нутризон, портаген, энтритион, изокал и др.). Пациентам с нарушением всасывания назначают диету с повышенным количеством белка (до 130 г/сут). Основным методом устранения гипопротеинемии является длительное внутривенное введение белоксодержащих растворов, в первую очередь альбумина и гамма-глобулина. Всем больным показаны препараты калия, кальция, железа. Дважды в год назначают курсы лечения витаминами.Пациентам с ЭП инфекционной этиологии назначают антибиотики.
При болезни Уиппла и ЭП, ассоциированной с лимфангиэктазиями, лечение начинают с введения цефтриаксона по 1 г в/в или в/м каждые 24 часа в течение 2 недель. Затем назначают антибиотики, которые способны проникать через гематоэнцефалический барьер. К таким препаратам относится сочетание триметоприма по 160 мг/сут с сульфаметоксазолом по 1,6 г/сут внутрь. Лечение обычно продолжается от 1 до 2 лет и прекращается только после исчезновения РАS-положительных макрофагов в СОТК. Пациентам с тропической спру и инфекционными гастроэнтеритами обычно назначают антибиотики из группы хинолонов II поколения (ципрофлоксацин) и нитрофураны (фуразолидон и др.). К препаратам с этиотропным механизмом также относятся антибиотики местного действия и кишечные антисептики, предотвращающие избыточный рост микрофлоры в тонкой кишке. В последние годы предпочтение отдается более современному и безопасному рифаксимину. Рифаксимин-альфа (Альфа Нормикс, Alfa Wassermann (Италия)) имеет широкий спектр антибактериальной активности, воздействуя на большинство грамположительных и грамотрицательных как аэробных, так и анаэробных бактерий. Рифаксимин-альфа демонстрирует практически полное отсутствие всасывания в желудочно-кишечном тракте. Это было убедительно доказано в экспериментальных исследованиях у животных, а затем в клинических исследованиях у здоровых добровольцев и пациентов с заболеваниями кишечника. Всасыванию рифаксимина-альфа препятствует наличие в его молекуле пиридоимидазо-группы, электрический заряд и ароматическое кольцо которой препятствуют прохождению через эпителий кишечника. Установлено, что при пероральном приеме рифаксимина-альфа натощак в крови обнаруживается не более 0,4% от принятой дозы. Минимальное всасывание действующего вещества в плазму крови снижает риск возникновения системных побочных эффектов, внекишечных лекарственных взаимодействий с другими препаратами, а у пациентов с заболеваниями печени и почек нет необходимости в коррекции дозы. В последние десятилетия эффективность рифаксимина-альфа активно изучалась в зарубежных и российских плацебоконтролируемых исследованиях. Рекомендуется следующая схема приема препарата: 800–1200 мг/сут (2 таблетки по 200 мг 2–3 раза в день) в течение 7 дней, ежемесячно с проведением повторных курсов через 20–40 дней по мере необходимости. Патогенетическая терапия. В лечении ЭП неизвестной этиологии (БК, аутоиммунная ЭП, коллагеновая спру, рефрактерная спру, ГГГС ) применяют системные и топические глюкокортикостероиды (будесонид), препараты 5-аминосалициловой кислоты (Пентаса), иммунодепрессанты (азатиоприн и др.), ингибиторы ФНО-альфа (инфликсимаб, адалимумаб). В ЦНИИГ нами успешно применяется трансплантация аллогенных мезенхимальных стволовых стромальных клеток [8]. В случае осложнения рефрактерной целиакии развитием Т-клеточной лимфомы можно добиться полной ремиссии заболевания с помощью высокодозной полихимиотерапии и трансплантации аутологичных стволовых клеток [9]. В механизмах развития любой ЭП одно из ведущих мест занимает нарушение кишечного пищеварения и всасывания и, как следствие, предрасположенность к избыточному росту микробной флоры в тонкой кишке. Поэтому при обострениях любой ЭП показана антибактериальная терапия (рифаксимин-альфа или кишечные антисептики). С целью восстановления структуры и пищеварительно-транспортной функции СОТК применяются энтеропротекторы. Энтеропротектор Энтеросан зарегистрирован в России в 1998 г. как оригинальное лекарственное средство, содержащее природную смесь полимеризированного секрета мышечного отдела желудка птиц. Он содержит гликопротеины, полисахариды, гликозаминогликаны, сиаломуцины, регуляторные пептиды, желчные и нуклеиновые кислоты, протеолитические ферменты. Каждый из компонентов влияет на морфологию и функцию эпителиоцитов СОТК. Энтеросан способен повышать барьерную функцию кишечника, улучшать активность и синтез пищеварительных ферментов тонкой кишки. Препарат способствует улучшению всасывания, восстановлению нормальной кишечной микрофлоры, устранению избыточного роста микробной флоры в тонкой кишке. Энтеросан назначают по 1-й капсуле (0,3 г) 3 раза в день за 15 минут до еды. Курс лечения – 3 недели [10]. К препаратам с патогенетическим механизмом, направленным на улучшение структуры и функции кишечника, относятся также пробиотики. Вырабатываемые симбионтной микрофлорой короткоцепочечные жирные кислоты оказывают разностороннее действие на клеточную дифференциацию, пролиферацию и апоптоз эпителиоцитов кишечника, индукцию продукции антимикробных пептидов, нейротрансмиттеров, гормонов, подвижность кишечника, иммунитет, межклеточные взаимоотношения и т.д. [11]. Поэтому пробиотики (Бифиформ, Пробифор и др.), пребиотики (Инулин, лактулоза, Лизоцим и др.) или их комбинации (Бактистатин) находят все большее распространение в терапии болезней кишечника. Длительность приема 2–3 недели. Симптоматическая терапия. Симптоматические средства используются при лечении всех ЭП. Для улучшения кишечного пищеварения показаны ферментные препараты, улучшающие кишечное пищеварение (Креон, Лактаза), энтеросорбенты (Смекта, лигнин гидролизный), регуляторы моторики кишечника (тримебутин, лоперамид), регуляторы кишечной секреции (соматостатин).Нозологическая диагностика ЭП остается одной из сложных в клинике внутренних болезней. Особенно трудными для распознавания являются формы целиакии, нечувствительные к глютену (рефрактерная, коллагеновая и ГГГС), и аутоиммунные ЭП. Большие сложности представляет дифференциальная диагностика гранулематозных и негранулематозных ЭП, эрозивно-язвенных поражений СОТК различной этиологии. Тем не менее существующие лабораторно-инструментальные методы исследования и предложенный алгоритм позволяют у значительного числа больных установить причину ЭП, назначить этиотропное лечение и добиться выздоровления.
umedp.ru
Диагностика и лечение энтеропатий | Парфенов А.И.
Энтеропатии – общее название болезней тонкой кишки различного происхождения, объединяемых развитием воспалительных изменений слизистой оболочки тонкой кишки (СОТК), нередко заканчивающихся атрофией ворсинок и эрозивно-язвенными поражениями. В таблице 1 представлены наиболее известные энтеропатии и вызывающие их этиологические факторы.
ЭтиологияЭтиология большинства энтеропатий достаточно хорошо известна [1]. Примерами служат глютенчувствительная целиакия (ГЦ), энтеропатии, вызываемые бактериями, вирусами, грибами и паразитами, лекарствами (нестероидные противовоспалительные препараты (НПВП), антибиотики), пищевыми аллергенами. Энтеропатию могут вызывать физические факторы (радиация, токсины), аномалии развития артериовенозных и лимфатических сосудов (мальформации), гастрэктомия и хронические заболевания кровеносных сосудов, крови, почек, соединительной ткани, эндокринной и иммунной системы. Правильно установленный нозологический диагноз при перечисленных выше заболеваниях тонкой кишки дает возможность добиться выздоровления с восстановлением структуры СОТК или клинико-морфологической ремиссии при условии исключения влияния этиологического фактора и оптимального лечения основного заболевания.
Наиболее тяжелыми и прогностически неблагоприятными являются энтеропатии, причину которых установить не удается. К ним относятся аутоиммунная энтеропатия с образованием антител к энтероцитам, коллагеновая спру, рефрактерная спру, гипогаммаглобулинемическая спру, гранулематозный регионарный энтерит (болезнь Крона), идиопатический негранулематозный илеит, эозинофильный гастроэнтерит, энтеропатия, развивающаяся при синдроме «трансплантат против хозяина», а также энтеропатия с потерей (экссудацией) белка в просвет кишки.
Экссудативная энтеропатия не является отдельной нозологической формой. Она может быть первичной (вследствие аномалии развития) и вторичной лимфангиоэктазией. Вторичные формы возникают в результате механической или функциональной блокады лимфатического аппарата кишечника воспалительной или опухолевой природы. Синдром экссудативной энтеропатии развивается при болезни Уиппла, заболеваниях сосудов, правожелудочковой недостаточности различной этиологии.
Патоморфология
Патоморфология большинства энтеропатий не имеет строго патогномоничных нозологических критериев. Исключение составляют целиакия, болезнь Уиппла, гипогаммаглобулинемическая спру, коллагеновая спру, болезнь Крона, при которых патогистологическая картина позволяет установить точный нозологический диагноз. Для целиакии характерны атрофия ворсинок, углубление крипт, лимфоплазмоцитарная инфильтрация собственной пластинки и энтероцитов.
При гипогаммаглобулинемической спру структура СОТК сходна с целиакией, но отличается почти полным отсутствием в инфильтрате плазматических клеток.
При коллагеновой спру под базальной мембраной энтероцитов образуется слой коллагена. Для болезни Уиппла характерно наличие РАS-положительных макрофагов в собственной пластинке СОТК.
Болезнь Крона характеризуется развитием гранулематозного воспаления стенки кишки с наличием в ней гранулем, содержащих гигантские клетки Пирогова–Лангханса (рис. 1), которые можно обнаружить только в операционном материале вследствие локализации их в подслизистом слое кишки.
При остальных видах энтеропатий патогистологические изменения менее специфичны или вовсе не являются специфическими для конкретной формы (инфекционной, радиационной и др.) энтеропатии.
Многие энтеропатии характеризуются образованием небольших интестинальных язв. Примером могут служить энтеропатии, ассоциированные с артериовенозными и лимфатическими мальформациями СОТК. При повреждении (изъязвлении) этих сосудистых образований появляются оккультные кровотечения.
В редких случаях язвенный еюнит может быть проявлением негранулематозного хронического энтероколита неизвестной этиологии. Аутоиммунная энтеропатия – жизнеугрожающее заболевание преимущественно у детей раннего возраста и почти исключительно у мужчин. Она характеризуется образованием антител к собственным энтероцитам СОТК. Биопсия СОТК показывает частичную или полную атрофию ворсинок и гиперплазию крипт, инфильтрацию мононуклеарами собственной пластинки и поверхностного эпителия. Некоторые из этих пациентов имеют дефицит иммуноглобулина (ИГ) А. Аутоиммунная энтеропатия часто имеет рефрактерное течение с плохим прогнозом.
Клинические особенности
Клиническая картина энтеропатий в общих чертах характеризуется сочетанием хронической диареи и синдрома нарушенного всасывания. Болевой синдром отсутствует или незначительный, но при нарушении проходимости тонкой кишки может быть ведущим в клинической картине.
При исследовании крови часто выявляется микроцитарная или В12-дефицитная анемия, причиной которой является снижение всасывания железа, витамина В12 и фолиевой кислоты. Лейкоцитоз, ускоренная СОЭ, повышение уровня С-реактивного белка (СРБ), фекального кальпротектина (ФКП) свидетельствуют о воспалительном происхождении заболевания тонкой кишки. Снижение в сыворотке крови содержания ионов калия, кальция, магния и хлора, белка, холестерина указывает на плохое всасывание их в тонкой кишке, а снижение ИГ является одним из признаков гипогаммаглобулинемической спру.
Хронический негранулематозный идиопатический энтерит протекает с болями в животе, анорексией, похудением, лихорадкой, поносом, стеатореей, гипоальбуминемией и гипопротеинемией. Воспалительные изменения СОТК могут сочетаться с неспецифическими дуодено-еюнальными язвами. Основным симптомом энтеропатии, ассоциированной с артериовенозными мальформациями СОТК, могут быть кровотечения, источником которых служат повреждения (изъязвления) артериовенозных ангиоэктазий. При лимфангиоэктазиях возникает избыточная потеря белка в просвет кишки.
Экссудативная энтеропатия может появиться и у больного ГЦ. Если гипопротеинемия и гипопротеинемические отеки прогрессируют на фоне строгого соблюдения аглютеновой диеты (АГД) и парентерального вливания белковых препаратов, то можно с большой долей вероятности предположить развитие энтеропатии, ассоциированной с Т-клеточной лимфомой (АЭТЛ). Диагноз АЭТЛ подтверждается гистохимическим исследованием СОТК. Если прогрессирующее ухудшение состояния наступает у больного с только что выявленной ГЦ и не улучшается на фоне соблюдения АГД, то требуется дифференциальный диагноз как с лимфомой, так и с рефрактерной и неклассифицированной формами целиакии.
Диагностика
Нозологическая характеристика энтеропатий улучшалась по мере усовершенствования иммунологических, эндоскопических и рентгенологических методов диагностики тонкой кишки [2]. На схеме 1 показаны возможности каждого из них. Ведущую роль в дифференциальной диагностике ГЦ с энтеропатиями, не связанными с целиакией, играет биопсия СОТК. Диагностика может быть сложной, т.к. у некоторых пациентов с целиакией антител к тканевой трансглютаминазе (АТтТГ) может не быть на момент постановки диагноза [3], а восстановление СОТК может быть очень медленным, несмотря на строгое соблюдение АГД [4].
Изменения СОТК, сходные с целиакией, могут быть и при других заболеваниях. Например, похожая атрофия слизистой оболочки проксимального отдела двенадцатиперстной кишки наблюдается у некоторых больных кислотозависимыми заболеваниями под влиянием пептического фактора. Дифференциальной диагностике в этих случаях помогают отрицательные результаты иммунологических исследований на АТтТГ и антитела к диамидированному пептиду глиадина (АТДПГ) [5]. Атрофию ворсинок, напоминающую таковую при ГЦ, можно также увидеть у больных с общим вариабельным иммунодефицитом, особенно при наличии симптомов мальабсорбции [6]. В этом случае должна быть исключена гипогаммаглобулинемическая спру [1].
Воспалительные заболевания кишечника (ВЗК) являются второй наиболее распространенной причиной атрофии ворсинок после ГЦ [7]. Ответ на АГД является тестом на целиакию, хотя улучшение может наблюдаться и при энтеропатии, не связанной с глютеном [8]. Поэтому этот симптом следует оценивать с осторожностью, как диагностический признак. У больных с незначительным повышением АТтТГ и субэпителиальных депозитов (СЭД) ИГА АТтТГ рекомендуется проводить тест на HLADQ2/DQ8. Диагностика целиакии с использованием генотипов HLA-DQ2 и HLA-DQ8 основана на тесной связи между ГЦ и определенными типами HLA: более чем у 95% больных – DQ2-положительные, а почти все остальные – DQ8-положительные.
Наиболее распространенной энтеропатией, не связанной с глютеном, является аутоиммунная энтеропатия. Она напоминает целиакию гистологически, а клинически похожа на другие болезни иммунной системы. Иммунная энтеропатия может быть причиной тяжелого синдрома нарушенного всасывания. Истинная эпидемиология и патогенез этого заболевания неизвестны и требуют дальнейшего изучения.
Диагноз аутоиммунной энтеропатии является оправданным, когда пациент не отвечает на терапию АГД при нетипичной клинической картине ГЦ. Диагностике помогают первоначальные результаты серологических тестов на целиакию, определение антител к энтероцитам, HLA DQ2/DQ8 тестирование, повторная биопсия и сравнение гистологической картины с ранее выполненной биопсией СОТК.
Дифференциальная диагностика энтеропатий
Современные эндоскопические методы хотя и повысили уровень диагностики заболеваний тонкой кишки, но не решили многих проблем. Это связано с тем, что патоморфологические проявления энтеропатий имеют много общего и в большинстве случаев отличаются лишь глубиной и протяженностью поражения СОТК. Характерными признаками энтеропатии являются изменения слизистой оболочки, формы и высоты складок, просвета кишки, ее тонуса, а также эрозии и язвы. Все эти признаки не являются специфическими для конкретной нозологической формы. Так, показанные на рисунке 2 афты СОТК, обнаруженные у больного гранулематозным илеитом Крона, можно наблюдать и у больных с НПВП-ассоциированной энтеропатией. Более точные данные для нозологического диагноза можно получить при гистологическом исследовании биоптатов, благодаря которым можно установить целиакию, болезнь Уиппла, гипогаммаглобулинемическую спру.
О трудностях дифференциальной диагностики энтеропатий можно судить по следующему клиническому наблюдению.
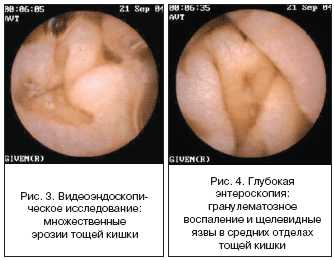
Больной Т., 45 лет на протяжении 2-х лет безуспешно лечился по поводу постоянных болей в мышцах, причину которых установить не удавалось. Боли в мышцах становились все более сильными, и больной потерял трудоспособность. В связи с безуспешностью лечения в 2004 г. направлен в Центральный научно-исследовательский институт гастроэнтерологии. В отделении патологии кишечника института больному провели глубокую еюноскопию и видеокапсульную энтероскопию.
При капсульной видеоэндоскопии (рис. 3) и глубокой эндоскопии (рис. 4) у больного обнаружены воспалительные изменения тонкой кишки с характерными для болезни Крона эрозиями и щелевидными язвами.
Установлен диагноз: гранулематозный еюнит (болезнь Крона) с внекишечными проявлениями в виде тяжелой миалгии. Назначено лечение месалазином и преднизолоном. Наступило выздоровление. Тем не менее аутоиммунный патогенез миалгий и отсутствие в последующие годы рецидивов заболевания не позволяют полностью исключить возможности аутоиммунной энтеропатии, протекавшей без клинических кишечных симптомов.
Ультразвуковые и рентгенологические методы исследования тонкой кишки также помогают обнаружить признаки энтеропатии, но на более продвинутой стадии, когда появляются глубокие язвы, сужения и свищи, особенно характерные для гранулематозного воспаления при болезни Крона.
Применение компьютерной томографии (КТ), мультиспиральной компьютерной томографии (МСКТ) и магнитно-резонансной томографии (МРТ), особенно с контрастным исследованием тонкой кишки, позволило вывести рентгенологический метод на новый уровень, т.к. стало возможным визуализировать всю стенку кишки и оценивать степень и глубину поражения.
На схеме 2 показан алгоритм дифференциальной диагностики энтеропатий.
Лечение
В таблице 2 приведены принципы терапии энтеропатий.
Лечение энтеропатий может быть этиотропным, патогенетическим и симптоматическим. Этиотропное лечение применимо к болезням с известной этиологией. Больным ГЦ назначают пожизненно АГД. При болезни Уиппла показана длительная (до 1 года и более) антибактериальная терапия, при тропической спру и инфекционных гастроэнтеритах – обычный курс лечения антибиотиком или кишечным антисептиком. У больных аллергическим гастроэнтеритом выздоровлению способствуют исключение из рациона пищевых аллергенов и антигистаминные средства.
В остальных случаях назначают диету, бедную длинноцепочечными и обогащенную среднецепочечными триглицеридами, которые содержатся в пищевых смесях, предназначенных для энтерального питания (нутризон, портаген, энтритион, изокал и др.). Диета должна содержать повышенное количество белка (до 130 г/сут.). Основным методом устранения гипопротеинемии является длительное внутривенное введение белоксодержащих растворов, в первую очередь альбумина и γ-глобулина. Всем больным показаны препараты кальция, железа. Дважды в год всем больным с мальабсорцией назначают курсы лечения витаминами.
Патогенетические средства применяют для лечения энтеропатий неизвестной этиологии (болезнь Крона, аутоиммунная энтеропатия, коллагеновая спру, рефрактерная спру, гипогаммаглобулинемическая спру). Они направлены на устранение воспалительного процесса. При болезни Крона и других аутоиммунных заболеваниях применяют системные и топические кортикостероиды, препараты 5-аминосалициловой кислоты (5-АСК), иммуносупрессанты, ингибиторы фактора некроза опухоли-α. В ЦНИИГ с успехом применяется терапия ВЗК аллогенными мезенхимальными стволовыми стромальными клетками [9].
Симптоматическая терапия применяется при лечении всех энтеропатий. Для улучшения кишечного пищеварения назначают панкреатические ферменты. Одним из них является Эрмиталь.
Эрмиталь содержит стандартный высокоактивный панкреатин, полученный из поджелудочной железы свиньи в виде микротаблеток, резистентных к воздействию желудочного сока. Входящие в состав ферменты липаза, альфа-амилаза, трипсин, химотрипсин способствуют расщеплению белков до аминокислот, жиров – до глицерина и жирных кислот, крахмала – до декстринов и моносахаридов, нормализуют процессы пищеварения.
Дозировка 10 000 ЕД: 1 капсула с резистентными к желудочному соку микротаблетками содержит 87,28–112,9 мг панкреатина из поджелудочной железы свиньи, что соответствует активности липазы 10 000 ЕД, амилазы 9 000 ЕД, протеаз 500 ЕД.
Дозировка 25 000 ЕД: 1 капсула с резистентными к желудочному соку микротаблетками содержит 218,2–282,4 мг панкреатина из поджелудочной железы свиньи, что соответствует активности липазы 25 000 ЕД, амилазы 22 500 ЕД, протеаз 1 250 ЕД.
Дозировка 36 000 ЕД: 1 капсула с резистентными к желудочному соку микротаблетками содержит 272,02–316,68 мг панкреатина из поджелудочной железы свиньи, что соответствует активности липазы 36 000 ЕД, амилазы 18 000 ЕД, протеаз 1 200 ЕД.
Эрмиталь проглатывают целиком во время приема пищи, запивая большим количеством жидкости (вода, соки). Размельчение или разжевывание микротаблеток или добавление их к пище с pН<5,5 приводит к разрушению их оболочки, защищающей от действия желудочного сока. Рекомендуемая доза составляет 2–4 капс. препарата Эрмиталь 10 000 ЕД, или 1–2 капс. по 25 000 ЕД, или 1 капс. по 36 000 ЕД во время каждого приема пищи.
С целью уменьшения бродильных и гнилостных процессов в кишечнике назначают противодиарейные средства: энтеросорбенты, регуляторы моторики (прокинетики) и кишечной секреции (соматостатин), а также энтеропротекторы, стимулирующие репаративные процессы в СОТК [10].
Схема лечения пациентов с энтеропатиями: сначала назначают препараты для подавления синдрома избыточного бактериального роста, назначают кишечные антисептики в течение 6–7 дней, затем – пробиотики и пребиотики – продукты метаболизма нормальных микроорганизмов и субстраты, способствующие поддержанию жизнедеятельности полезных микробов. Дополнение пищевого рациона пребиотиками увеличивает концентрацию короткоцепочечных жирных кислот в кишечнике и тем самым улучшает его анатомическую структуру и моторно-эвакуаторную функцию. Пребиотики можно доставлять в организм в составе синбиотиков, включающих живые пробиотические бактерии и комплексные добавки, используемые микробиотой в качестве источника энергии и роста.
Интересен Бактистатин, сочетающий в себе свойства пробиотика, пребиотика и энтеросорбента, который с успехом применяется при данной патологии. Бактистатин представляет собой комбинацию стерилизованной культуральной жидкости Bacillus subtilis 3: бактериоцины, лизоцим, каталазы, подавляющие рост условно-патогенных микроорганизмов (пробиотическая составляющая), цеолита (сорбент) и соевой муки (пребиотическая составляющая).
Антибиотикоподобные вещества и ферменты, продуцируемые бактериями Bacillus subtilis, стимулируют рост и активность собственной симбионтной микрофлоры. Вырабатываемые в процессе ферментации бактериями аминокислоты, антигены, полипептиды и другие биологически активные вещества обладают иммуномодулирующим действием за счет стимуляции синтеза эндогенного интерферона и активации макрофагов. Таким образом, пребиотические соединения в составе Бактистатина обеспечивают восстановление нормальной микрофлоры кишечника, повышают неспецифическую резистентность организма, способствуют полноценному пищеварению.
Цеолит – природный сорбент, обладающий ионообменными свойствами, проявляет сорбционные свойства преимущественно по отношению к соединениям с низкой молекулярной массой (метан, сероводород, аммиак и другие токсические вещества). Цеолит улучшает процессы пищеварения за счет увеличения площади биохимических реакций в кишечнике, сорбции низкомолекулярных метаболитов и нормализации состояния кишечной микрофлоры, нормализует перистальтику, ускоряя продвижение содержимого кишечника по пищеварительному тракту. Гидролизат соевой муки является естественным источником полноценного белка и аминокислот, обеспечивает максимально благоприятные условия для бесконкурентного роста нормальной микрофлоры кишечника и восстановления микробного пейзажа организма. Установлено, что Бактистатин является эффективным средством для коррекции внутриполостной кишечной среды, что выражается изменением профиля метаболитов микрофлоры, в частности короткоцепочечных жирных кислот, значениями анаэробного индекса, характеризующего окислительно-восстановительный потенциал внутрипросветной среды [11]. Бактистатин назначают внутрь по 1–2 капс. 2 раза в сутки во время еды. Длительность приема – 2–3 нед.
Заключение
Нозологическая диагностика энтеропатий – одна из сложнейших задач в клинике внутренних болезней. Особенно трудными для распознавания являются формы целиакии, нечувствительные к глютену (рефрактерная, коллагеновая и гипогаммаглобулинемическая спру, аутоиммунные энтеропатии). Значительные сложности возникают при дифференциальной диагностике энтеропатий с эрозивно-язвенными поражениями СОТК. Тем не менее существующие лабораторно-инструментальные методы исследования позволяют у значительного числа больных установить причину энтеропатии, назначить этиотропное лечение и добиться выздоровления.

Литература
1. Парфенов А.И. Энтерология: руководство для врачей. Изд. 2-е М.: МИА, 2009.
2. Щербаков П.Л. Успехи эндоскопии в диагностике и лечении болезней тонкой кишки // Тер. арх. 2013. № 85 (2). С. 93–95.
3. Leffler D.A., Schuppan D. Update on serologic testing in celiac disease // Am J Gastroenterol. 2010. Vol. 105. Р. 2520–2524.
4. Rubio-Tapia A., Rahim M.W., See J.A. et al. Mucosal recovery and mortality in adults with celiac disease after treatment with a gluten-free diet // Am J Gastroenterol. 2010. Vol. 105. Р. 1412–1420.
5. Гудкова Р.Б., Парфенов А.И., Сабельникова Е.А. Значимость антител к диамидированному пептиду глиадина при целиакии взрослых: Сб. тезисов XXXIX сессии ЦНИИГ «Мультидисциплинарный подход к гастроэнтерологическим проблемам». М., 2013. С. 98-99.
6. Malamut G., Verkarre V., Suarez F. et al. The enteropathy associated with common variable immunodeficiency: the delineated frontiers with celiac disease // Am J Gastroenterol. 2010. Vol. 105. Р. 2262–2275.
7. Ludvigsson J.F., Brandt L., Montgomery S.M. et al. Validation study of villous atrophy and small intestinal inflammation in Swedish biopsy registers // BMC Gastroenterol. 2009. Vol. 9. Р. 19.
8. Biesiekierski J.R., Newnham E.D., Irving P.M. et al. Gluten causes gastrointestinal symptoms in subjects without celiac disease: a double-blind randomized placebo-controlled trial // Am J Gastroenterol. 2011. Vol. 106. Р. 508–514.
9. Князев О.В., Ручкина И.Н., Парфенов А.И. и др. Эффективность аллогенных мезенхимальных стромальных клеток костного мозга у больных с рефрактерной формой болезни Крона. 5 лет наблюдения: Сб. тезисов XXXIX сессии ЦНИИГ «Мультидисциплинарный подход к гастроэнтерологическим проблемам». М., 2013. С. 98–99.
10. Парфенов А.И., Ручкина И.Н. Энтеросан – перспективный лекарственный препарат для лечения больных постинфекционным синдромом раздраженного кишечника // Эксперим. и клин. гастроэнтерология. 2011. № 3. С. 102–104.
11. Ардатская М.Д., Минушкин О.Н. Синдром избыточного бактериального роста: определение, современные подходы к диагностике и лечебной коррекции. Сonsilium medicum (приложение Гастроэнтерология) 2012; 2 : 72–76.
www.rmj.ru
Инновационный гастро- и энтеропротектор нового поколения
В связи с возрастающей интенсивностью назначения противовоспалительных нестероидных препаратов, аспирина в кардиологии все большую актуальность приобретают гастропротекторы и энтеропротекторы последнего поколения, среди которых есть ребагит.
Немного истории
В 1998 году японские ученые T.Arakawa, T.Yoshikawa, K.Kobayashi представили экспериментальное подтверждение лечебных качеств препарата, который получил торговое название ребагит (другое название ребамипид). Препарат показал себя как прекрасный индуктор, способствующий в клетках слизистой желудочно-кишечного тракта синтезу простагландинов Е2 и GI2, физиологически активных веществ, ответственных за:
- увеличение просвета кровеносных сосудов в гладкой мускулатуре ЖКТ и, как следствие, усиление кровотока;
- снижение скорости выделения кислоты желудком;
- усиление выделения желудком слизи;
- ингибирование процессов липолиза;
- повышает активность автономных нейротрансмиттеров;
- подавляет процессы агрегации тромбоцитов и снижает риск образования тромбов.
Также было показано, что препарат снижает болевые ощущения.
Все это позволило применять его в качестве гастропротектора и энтеропротектора.
Дальнейшие исследования
В 2007 году T.Arakawa и A.Terano показали эффективность препарата в заживлении язв желудка, вызванных бактериями H. Pylori. Успешность применения этого лекарства превысила 80% при назначении 100 миллиграммов препарата (три раза ежесуточно) в течение семи недель.
В 2008 году китайские исследователи Y.Du, Z.Li, X Zhan изучили противовоспалительные свойства ребагита и пришли к выводу, что препарат многократно превосходит часто назначаемый сукральфат по таким показателям, как:
- скорость эпителизации эрозий, имеющихся в желудке;
- скорость купирования симптоматики и снижение болевых ощущений.
В 2011 году корейскими и японскими учеными были изучены гастропротекторные возможности ребагита в профилактике при лечении больных препаратами НПВП и показаны его замечательные возможности для снижения возникающих язвенных эффектов.
Несколько позже, в 2012 году корейские ученые S.J. Kim, W.G. Shin , M.H. Choi обнаружили, что лекарство ускоряет заживление ран ЖКТ после хирургического вмешательства, снижает частоту возникающих грануляций.
В настоящее время опубликовано более 70-ти научных работ, подтверждающих отличные гастропротекторные и энтеропротекторные качества ребагита.
Рекомендации
Гастро- и энтеропротектор ребагит назначают при:
- язвенной болезни желудка, в том числе и вызванной бактериями H. Pylori;
- необходимости лечения хронического гастрита в стадиях обострения;
- эрозивных гастритах;
- необходимости предотвращения повреждений слизистой при приеме нестероидных противовоспалительных лекарств;
- комбинированной терапии.
Препарат в России рекомендован:
- Общероссийской общественной организацией «Ассоциация врачей общей практики»;
- Научным обществом гастроэнтерологов России;
Экспертным советом Российской гастроэнтерологической ассоциации.
vistanews.ru
Защита желудка (Гастропротекция) | «Все о желудке и ЖКТ»
Понятие гастропротекции связано с защитными механизмами слизистой оболочки желудка от агрессивных факторов экзогенного (внешнего) и эндогенного (внутреннего) характера. У пищеварительной системы есть естественные ресурсы, для того чтобы справляться с болезнетворными бактериями и токсинами, соляной кислотой и пепсином. Но если их не хватает, «в игру вступает» гастропротекторная терапия.
АГРЕССИВНЫЕ ФАКТОРЫ В РАЗВИТИИ ПОВРЕЖДЕНИЙ СЛИЗИСТОЙ ЖЕЛУДКА
Экзогенные факторы – это всё, что поступает в организм человека извне: пища, алкоголь, табак, лекарственные препараты. Эндогенные факторы желудочно-кишечный тракт ежедневно производит сам. Это вещества, участвующие в процессе пищеварения. При определённых условиях желудочный сок (соляная кислота), пепсин, липаза и желчные кислоты могут начать процесс разрушения пищеварительной системы.
К примеру, гастрит. В 90% случаев он развивается в результате активизации в организме бактерии Helicobacter pylori. Под её воздействием слизистая оболочка желудка начинает трескаться – образуются сначала микро-, потом макроповреждения. Соляная кислота попадает в эти трещины и воздействует на нервные окончания, туда же проникают болезнетворные бактерии и токсины… Боль в животе, изжога, отрыжка, вздутие – вот типичные симптомы, которые говорят о «пробоинах» в слизистой.
Конечно, у здорового человека против этих повреждающих факторов есть естественная защита. Физиологическую гастропротекцию регулируют простагландины Е1 и E2: они стимулируют секрецию слизи и бикарбонатов и подавляют выработку соляной кислоты. Но если этот механизм по каким-либо причинам даёт сбой, появляются условия для развития воспаления и язв в эпителиальном слое желудка и атрофии его железистого слоя.
ЛЕЧЕНИЕ ГАСТРОПРОТЕКТОРАМИ
Лечебная гастропротекция представляет собой комплекс мер, направленных на устранение эндогенных или экзогенных агрессивных факторов и стимулирование собственных факторов защиты. К ним относятся:
- лечебное питание;
- отказ от алкоголя и курения;
- эрадикация (полное уничтожение) H. Pylori;
- снижение секреции соляной кислоты;
- восстановление слизистощелочного барьера;
- восстановление эпителия желудка;
- улучшение микроциркуляции в желудочном эпителии.
Пять пунктов из этого набора обеспечивают лекарственные препараты, которые называются гастропротекторами. Их используют в лечении широкого спектра заболеваний, так как любая патология желудочно-кишечного тракта подразумевает повреждения слизистой оболочки желудка. Гастропротекторы помогают восстановить целостность слизистой, при этом стимулируют подъём собственных защитных сил организма.
Один из самых назначаемых сегодня гастропротекторов – это ребамипид. Он повышает уровень простагландинов Е1 и Е2 и «спаивает» не только микротрещины, но и макроповреждения: эрозии и язвы желудка и 12-перстной кишки. Раньше эти заболевания лечили антисекреторными препаратами – ингибиторами протонной помпы (ИПП). Как показала практика, частоту рецидивов в одиночку эти препараты не снижают. А вот в комплексе с ребамипидом эффективность на уровне.
Положительный эффект, полагают медики, связан с особенностями работы протектора: он подавляет деятельность лейкоцитов, что не только способствует рубцеванию язвы, но и снижает частоту рецидивов язвенной болезни.
Совместное применение ребамипида с ИПП:
- Ускоряет процесса образования рубцов;
- улучшает качество рубцевания;
- снижает вероятность повторного образования язв.
При этом, в отличие от других гастропротекторов (к примеру, мизопростола), ребамипид практически не даёт побочных эффектов: всего у 0,54% пациентов могут появиться неприятные симптомы, но и те не являются тяжёлыми и тем более жизнеугрожающими.
lechenie/preparat-rebamipid-rebagit-pokazaniya-i-protivopokazaniya-k-primeneniyu
vseojkt.ru
Гастро и энтеропротекторы – первоэлементы надежной защиты ЖКС
Гастро и энтеропротекторы — это группа соединений, осуществляющих безопасность структуры и цельность слизистой оболочки желудка и кишечника. В норме слизистая стенка, состоящая из слоя цилиндрических эпителиоцитов, вырабатывает защитную слизь с содержанием гликопротеинов и бикарбоната. Это ее свойство позволяет создать мощный барьер от воздействия эндогенных (ферменты, кислоты) и экзогенных (никотин, алкоголь, антибиотики) факторов. В результате заболеваний ЖКТ слизистая оболочка разрушается и функционирование слизеобразования снижается. В таких ситуациях без гастро и энтеропротекторов не обойтись.
Гастропротекторы или механические стражи
Ключевой ролью гастропротектров является образование пленки, защищающей слизистую стенку желудка, кишечника и эндотелий сосудов микро циркуляции, а также понижение активности кислот и пищеварительных ферментов. В основном — это химические вещества (висмута трикалия дицитрат, сукральфат) и народные средства (отвар семен льна, сок картофеля).
Энтеропротекторы, как ингибиторы физиологической защиты
Внутриклеточные гормоны или простагландины содержатся в клетках слизистой стенки, координируют желудочную секрецию, повышение кровотока в слизистой оболочке, стимулируют слизеобразование, способствуют увеличению выработки щелочных элементов, а также принимают участие в процессах репарации. Синтетические энтеропротекторы являются аналогами простагландинов.
Два в одном или препараты нового поколения
За последнее время в медицине совершились общезначимые преобразования — синтезировали вещества, объединившие в себе функции гастро и энтеропротекции одновременно. Гастропротектор и энтеропротектор — препараты нового поколения два в одном не уступают по эффективности старым лекарствам, а разительно превосходят их и имеют меньше противопоказаний. Эти лекарства обладают следующими свойствами.
- Продуцирование синтеза простагландинов в клетках слизистой оболочки. Результатом является улучшение кровообращения, снижение проницаемости стенок слизистой, повышение секреции слизи.
- Сочетание противовоспалительной, антибактериальной функций и способности к выведению свободных радикалов кислорода.
- Увеличение скорости вывода из организма, усиление регенеративных положительных изменений в системе ЖКТ при язвенных заболеваниях.
Изучение воздействия данных препаратов http://rebagit.ru/ позволили более подробно разобраться в патогенезе многих гастроэнтерологических заболеваний и процессе регуляции работы ЖКТ.
mednovelty.ru
